La progressiva espansione epidemiologica e geografica dell’infezione da Zika virus (ZIKV) dall’ottobre del 2013 (dalla Polinesia Francese al Brasile e ad altri paesi delle Americhe, con sporadica diffusione in Europa ed in Oriente) è da tempo segnalata come un’emergenza globale per la salute pubblica (link articolo 3 febbraio 2016). L’infezione, pur manifestandosi tipicamente come una febbre di breve durata, associata a rash maculo-papulare, cefalea, artro–mialgie e/o congiuntivite non purulenta, o decorrendo spesso completamente asintomatica, può associarsi a temibili complicanze, quali la comparsa di disturbi neurologici, con incrementato rischio di sindrome di Guillain-Barré (link articolo 4 maggio 2016), possibili sequele oftalmologiche (link articoli 1 aprile 2016 e 4 luglio 2016) e microcefalia congenita fetale (link articoli 29 febbraio e 30 marzo 2016). L’infezione da ZIKV è tipicamente una malattia vettoriale (principalmente attraverso la zanzara ‘Aedes aegypti’), ma sono state riconosciute numerose modalità di trasmissione secondarie (materno–fetale, etero– ed omo–sessuale, trasfusionale, a seguito di trapianti o attraverso primati non umani) (link articolo 30 marzo 2016). La persistenza nello sperma di ZIKV–RNA è stata segnalata fino a 9-10 settimane dall’esordio clinico della malattia virale, con finestra di trasmissione sessuale non del tutto chiarita. Dati a supporto dell’infezione verticale e del ruolo causale dello ZIKV nello sviluppo di malformazioni congenite includono il ritrovamento dello ZIKV–RNA o dell’antigene virale nel liquido amniotico, nella placenta o nel tessuto cerebrale di feti o neonati con microcefalia diagnosticata dopo la morte in utero o subito dopo la nascita. Inoltre, un recente studio prospettico (link articolo 30 marzo 2016) su gestanti brasiliane infette ha mostrato nel 29% dei feti anomalie quali microcefalia, ritardo di crescita e morte fetale.
Il New England Journal of Medicine ha pubblicato il 13 luglio un interessante articolo che fa il punto sui possibili meccanismi patogenetici di ZIKV in gravidanza attraverso modelli d’infezione animale. ZIKV appartiene alla famiglia dei Flavivirus che, per replicare all’interno delle cellule, devono superare la barriera dei segnali recettoriali indotti dall’interferon (IFN) tipo I (gli IFN sono citochine con proprietà antivirali, antiproliferative ed immunomodulatorie); in parte, lo ZIKV raggiunge questo obiettivo attraverso la degradazione delle molecole di segnale STAT2 (Signal Transducer and Activator of Transcription), il messaggero proteico attivato a cascata dal recettore dell’IFN. Attraverso modelli murini in gravidanza inoculati con diversi ceppi di ZIKV, è stato possibile riprodurre ciò che può accadere nelle donne che contraggano infezione da ZIKV nel corso del primo e secondo trimestre di gravidanza (nel terzo trimestre l’infezione non determina significative alterazioni fetali). Viene dimostrato un particolare tropismo dello ZIKV per le cellule dell’interfaccia materno–fetale (Fig. 1, pannello A) e, quindi, una via transplacentare d’infezione.
Il virus replica specificamente in sottogruppi di trofoblasti, in cellule endoteliali fetali e nei macrofagi della componente fetale della placenta (cellule di Hofbauer dello stroma dei villi). L’accesso a questi tipi cellulari può essere amplificato dal legame dello ZIKV al recettore della tirosin-kinasi, localizzato alla superficie cellulare e denominato AXL. Il virus riesce così a superare la barriera feto–placentare ed a colonizzare specificamente i progenitori neurali della corteccia cerebrale del feto di topo (Fig. 1, pannello B). Nelle fasi iniziali della gravidanza, l’infezione virale può determinare una severa insufficienza vascolare placentare ed una compromissione della vascolarizzazione fetale; alternativamente, lo ZIKV può attraversare la barriera placentare senza significativo danno tessutale locale e diffondere al tessuto cerebrale fetale, dove preferenzialmente infetta e danneggia le cellule progenitrici neuronali. Questo secondo scenario può essere più tipico d’infezioni gravidiche non precoci a causa dell’aumento dell’ immunità naturale indotta dall’IFN λ nei trofoblasti. L’infezione e la morte delle cellule neuroprogenitrici potrebbe inibire la differenziazione neuronale e spiegare l’assottigliamento corticale, la malformazione delle strutture cerebrali e la microcefalia associata a questa infezione. Vanno considerate le differenze morfologiche, spaziali e temporali della placentazione e dello sviluppo cerebrale in utero nei roditori e nell’uomo, sebbene molti elementi siano simili in entrambe le specie. I modelli murini, comunque, offrono la possibilità di definire i meccanismi patogenetici e rappresentano un approccio per studiare la correlazione tra i diversi ceppi di ZIKV e le manifestazioni cliniche e testare potenziali agenti terapeutici e vaccini.
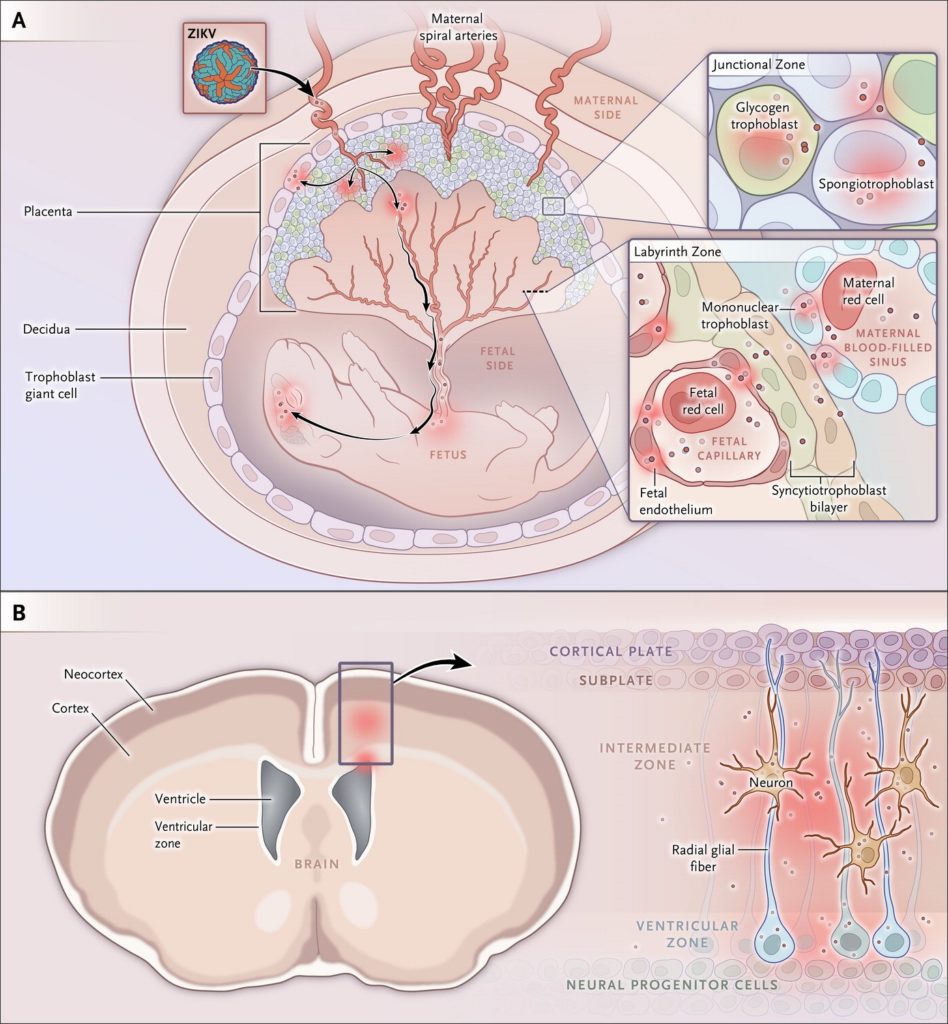
Figura 1. Siti cellulari d’infezione da Zika virus (ZIKV) in gravidanza.
La placenta murina comprende componenti di derivazione materna e fetale, includendo le zone ‘giunzionale’ e del ‘labirinto’ (pannello A). Lo ZIKV può infettare trofoblasti placentari, comprese le cellule giganti trofoblastiche, il glicogeno trofoblastico, gli spongiotrofoblasti nella zona giunzionale, le cellule mononucleate trofoblastiche, i sinusoidi materni e le cellule endoteliali fetali che circondano i capillari fetali nella zona del labirinto (inserto). Lo ZIKV infetta il cervello fetale murino con tropismo per le cellule della corteccia cerebrale e della zona ventricolare, includendo le cellule progenitrici neurali corticali e le cellule gliali radiali (pannello B).
N Engl J Med. 2016 Jul 13. [Epub ahead of print]
Modeling Zika Virus Infection in Pregnancy
Mysorekar IU, Diamond MS.