I coronavirus umani (HCoV) sono stati a lungo considerati patogeni insignificanti, causando il “raffreddore comune” in persone altrimenti sane. Tuttavia, nel 21 ° secolo, due HCoV altamente patogeni – la sindrome respiratoria acuta grave coronavirus (SARS-CoV) e la sindrome respiratoria del Medio Oriente (MERS-CoV) – si sono trasferiti nell’uomo dai serbatoi di animali causando epidemie globali con morbilità e mortalità allarmanti. Nel dicembre 2019, un altro patogeno HCoV, coronavirus 2019 (2019-nCoV), è stato identificato a Wuhan, in Cina, e ha causato gravi malattie e morte. La portata e l’effetto finali di questo focolaio non sono al momento chiari poiché la situazione si sta rapidamente evolvendo.
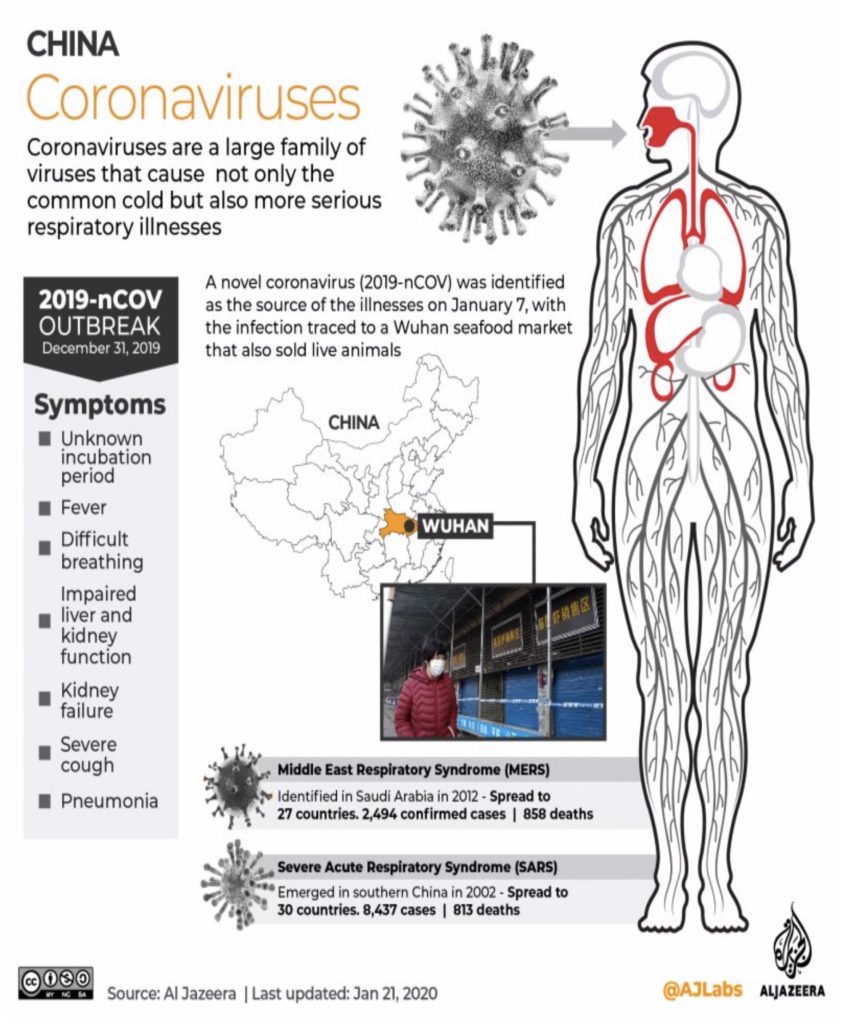
I coronavirus sono virus RNA di grandi dimensioni, che possono essere suddivisi in 4 generi: alfa, beta, delta e gamma, di cui è noto che i CoV alfa e beta infettano l’uomo . Quattro HCoV (HCoV 229E, NL63, OC43 e HKU1) sono endemici a livello globale e rappresentano dal 10% al 30% delle infezioni del tratto respiratorio superiore negli adulti. I coronavirus sono ecologicamente diversi e la più grande varietà è stata osservata nei pipistrelli; il che suggerisce che questi rappresentano i serbatoi di molti di questi virus . I mammiferi peridomestici possono servire da ospiti intermedi, facilitando gli eventi di ricombinazione e mutazione con l’espansione della diversità genetica.
Fino a poco tempo fa, gli HCoV hanno ricevuto relativamente poca attenzione a causa della loro modesta azione nell’uomo. Ciò è cambiato nel 2002, quando sono stati descritti casi di polmonite atipica grave nella provincia del Guangdong, in Cina, che hanno provocato preoccupazione in tutto il mondo a causa della diffusione della malattia attraverso i viaggi internazionali. La nuova malattia è diventata nota come sindrome respiratoria acuta grave (SARS), e un beta-HCoV, chiamato SARS-CoV, è stato identificato come agente causale. Poiché i primi casi condividevano una storia di contatto uomo-animale la trasmissione zoonotica del virus era fortemente sospettata. Inizialmente si pensava che gli zibetti di palma e i procioni fossero i serbatoi degli animali; tuttavia, quando sono stati resi disponibili più dati sulla sequenza virale, è emerso il consenso sul fatto che i pipistrelli fossero ospiti naturali.
I sintomi comuni della SARS includevano febbre, tosse, dispnea e occasionalmente diarrea. Dei pazienti infetti, dal 20% al 30% ha richiesto ventilazione meccanica e il 10% è deceduto, con tassi di mortalità più elevati nei pazienti più anziani e in quelli con comorbilità. La trasmissione da uomo a uomo è stata documentata, principalmente in contesti sanitari. Questa diffusione nosocomiale può essere spiegata dalla virologia di base: il recettore umano predominante per la glicoproteina S SARS, l’enzima 2 di conversione dell’angiotensina umana (ACE2), si trova principalmente nel tratto respiratorio inferiore, piuttosto che nelle vie aeree superiori. La distribuzione dei recettori può spiegare sia la carenza dei sintomi del tratto respiratorio superiore sia la scoperta che il picco di diffusione virale si è verificato in ritardo (≈10 giorni) nella malattia quando gli individui erano già ricoverati in ospedale.
Numerosi episodi pericolosi di diffusione trasmissione si sono verificati nelle comunità, come quello rappresentato dal mini-focolaio ben documentato presso l’Hotel Metropole di Hong Kong, da dove i clienti infetti hanno viaggiato e diffuso la SARS a livello internazionale. Altro focolaio si è verificato nel complesso residenziale Amoy Gardens in cui sono stati infettati più di 300 residenti, dimostrando possibile il verificarsi della trasmissione aerea di SARS-CoV. A quasi 20 anni dalla conoscenza di questi virus, i fattori associati alla trasmissione di SARS-CoV rimangono scarsamente compresi..
Alla fine, le classiche misure di sanità pubblica hanno posto fine alla pandemia di SARS, ma non prima che 8098 persone fossero state infettate e 774 morte. La pandemia costò all’economia globale una cifra stimata da 30 a 100 miliardi di dollari. Comunque la SARS-CoV ha dimostrato che è possibile saltare la barriera delle specie, ampliando in tal modo la percezione delle minacce pandemiche.
La MERS condivide molte caratteristiche cliniche con la SARS come la polmonite atipica grave, ma sono evidenti differenze chiave. I pazienti con MERS presentano importanti sintomi gastrointestinali e spesso insufficienza renale acuta, probabilmente spiegata dal legame della glicoproteina MERS-CoV S alla dipeptidil peptidasi 4 (DPP4), che è presente nelle vie aeree inferiori, nonché nel tratto gastrointestinale e nel rene. La MERS richiede una ventilazione meccanica nel 50-89% dei pazienti e ha un tasso di mortalità del 36% .2
Mentre MERS non ha causato il panico internazionale visto con la SARS, l’emergere di questo secondo HCoV zoonotico altamente patogeno conferma la minaccia rappresentata da questa famiglia virale. Nel 2017 l’OMS ha inserito SARS-CoV e MERS-CoV nell’elenco dei patogeni prioritari, sperando di stimolare la ricerca e lo sviluppo di contromisure contro i CoV.
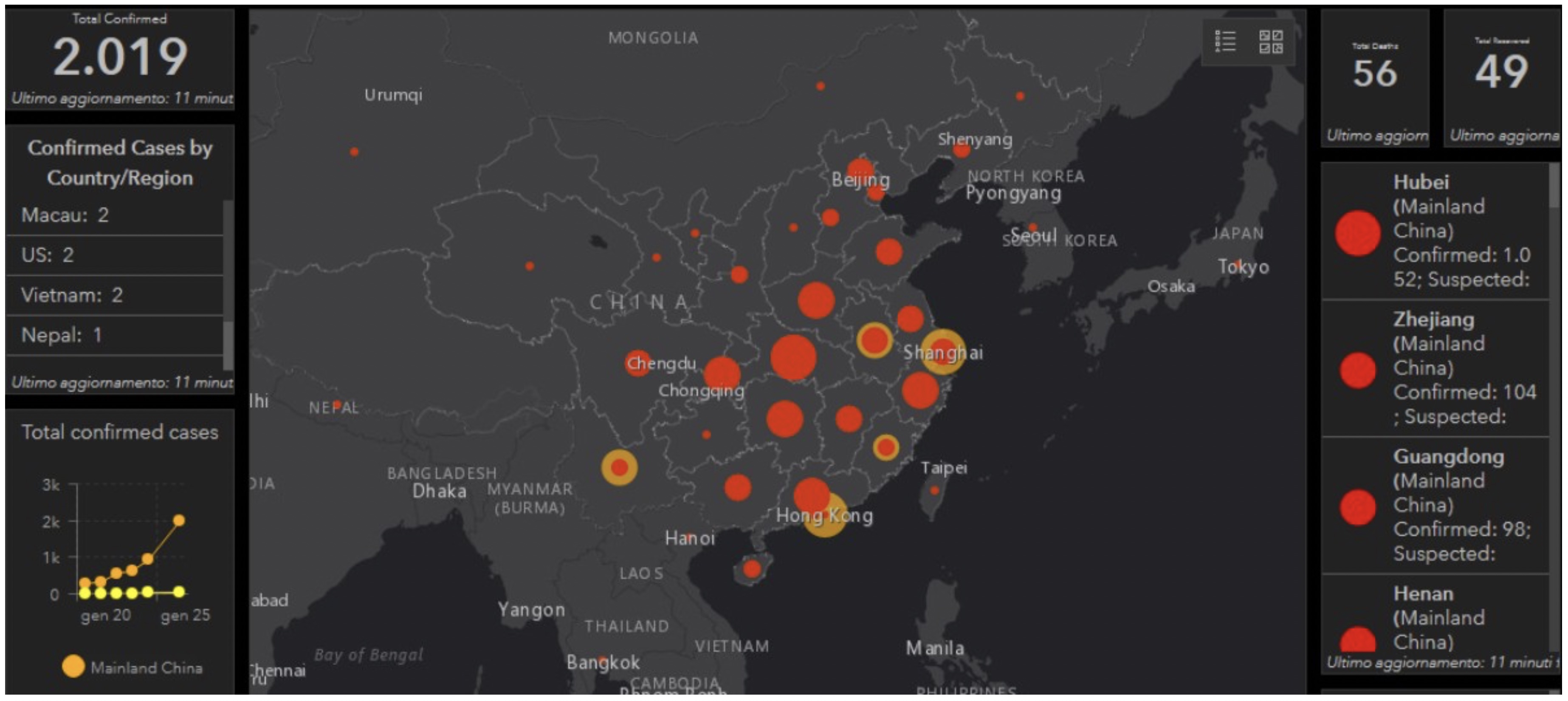
L’azione dell’OMS si è dimostrata premonitrice. Il 31 dicembre 2019, le autorità cinesi hanno segnalato un gruppo di casi di polmonite a Wuhan, in Cina, la maggior parte dei quali includeva pazienti che avevano riferito di un’esposizione a molte specie di animali vivi. Si sospettava l’emergere di un altro HCoV patogeno zoonotico e, entro il 10 gennaio 2020, i ricercatori del Centro clinico di salute pubblica di Shanghai e la School of Public Health e i loro collaboratori hanno rilasciato una sequenza genomica completa di 2019-nCoV in banche dati pubbliche, esemplificando la rapida condivisione dei dati in risposta alle epidemie. Le analisi preliminari indicano che 2019-nCoV ha una certa omologia di aminoacidi rispetto a SARS-CoV e potrebbe essere in grado di utilizzare ACE2 come recettore. Ciò ha importanti implicazioni per la previsione del potenziale pandemico . La situazione con 2019-nCoV si sta evolvendo rapidamente, con il conteggio dei casi attualmente in aumento a centinaia. Si dimostra quindi la trasmissione da uomo a uomo anche per il 2019-nCoV, come evidenziato dall’infezione di 15 operatori sanitari in un ospedale di Wuhan. Finora, sembra che il tasso di mortalità di 2019-nCoV sia inferiore a quello di SARS-CoV e MERS-CoV; tuttavia, resta da vedere la portata e gli effetti finali dell’epidemia.
I ricercatori biomedici hanno già iniziato lo sviluppo di contromisure per 2019-nCoV utilizzando SARS-CoV e MERS-CoV come prototipi. Ad esempio, le modalità diagnostiche della piattaforma vengono rapidamente adattate per includere 2019-nCoV, consentendo il riconoscimento e l’isolamento precoci dei casi. Antivirali ad ampio spettro, come remdesivir, un inibitore dell’RNA polimerasi, nonché lopinavir / ritonavir e interferone beta hanno mostrato risultati promettenti contro MERS-CoV in modelli animali . Durante la SARS, i ricercatori sono passati dall’ottenere la sequenza genomica di SARS-CoV a uno studio clinico di fase 1 di un vaccino a DNA in 20 mesi e da allora hanno compresso quella linea temporale a 3,25 mesi per altre malattie virali. Per 2019-nCoV c’è la speranza di muoversi ancora più velocemente, utilizzando la tecnologia del vaccino RNA messaggero (mRNA). Altri ricercatori sono allo stesso modo pronti a costruire vettori virali e vaccini subunità.
Sebbene lo sviluppo di questo focolaio sia impossibile da prevedere, una risposta efficace richiede un’azione tempestiva dal punto di vista dell’adozione delle classiche strategie di salute pubblica . L’emergere di un altro focolaio di malattia umana causato da un agente patogeno proveniente da una famiglia virale precedentemente ritenuta relativamente benigna sottolinea la perpetua sfida delle malattie infettive emergenti e l’importanza di una preparazione prolungata
RIFERIMENTI
- de Wilde AH, et al. Host factors in coronavirus replication. Curr Top Microbiol Immunol. 2018;419:1-42. doi:1007/82_2017_25PubMedGoogle Scholar
- de Wit E, et al. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14(8):523-534. doi:1038/nrmicro.2016.81PubMedGoogle ScholarCrossref
- Song Z,et al.. From SARS to MERS, thrusting coronaviruses into the spotlight. Viruses. 2019;11(1):11. doi:3390/v11010059PubMedGoogle ScholarCrossref
- Yu IT, et al. Evidence of airborne transmission of the severe acute respiratory syndrome virus. N Engl J Med. 2004;350(17):1731-1739. doi:1056/NEJMoa032867PubMedGoogle ScholarCrossref
- Sheahan TP, et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun. 2020;11(1):222. doi:1038/s41467-019-13940-6PubMedGoogle ScholarCrossref
- Graham BS, et al. Novel vaccine technologies: essential components of an adequate response to emerging viral diseases. JAMA. 2018;319(14):1431-1432. doi:10.1001/jama.2018.0345



