Nei pazienti con emofilia A la chirurgia rappresenta una sfida importante poiché è intrinsecamente associata ad un rischio emorragico, spesso determinato da fattori imprevedibili. Storicamente la chirurgia maggiore ha sempre richiesto una profilassi con alte dosi di fattore sostitutivo e nello stesso tempo somministrazioni con una frequenza maggiore per mantenere adeguati livelli plasmatici di F.VIII fino alla guarigione della ferita chirurgica.
L’introduzione dei prodotti ad emivita estesa ha cambiato i comportamenti dei clinici nella formulazione dei piani terapeuti per la profilassi in chirurgia. Infatti quest’ultimi per le loro caratteristiche sono in grado di assicurare un’emostasi efficace per periodi più lunghi, ovviamente con minori infusioni e potenzialmente con un minor consumo.
Nell’esperienza clinica, che qui andiamo a riassumere (E.Santagostino, S.Lalezari, M.T.Reding et al.- https://doi.org/10.1016/j.thromres.2019.08.023), gli autori hanno voluto valutare la sicurezza e l’efficacia del BAY 94-9027 per la prevenzione delle emorragie nel corso di interventi di chirurgia maggiore in adulti e adolescenti con grave emofilia A.
Il BAY 94-9027 (Jivi®; Bayer, Berkeley, CA, USA) è un fattore VIII ricombinante B-deleto (BDD) coniugato con un polietilenglicole di 60 kDa ramificato (PEG). I dati di farmacocinetica (PK) confermano che BAY 94-9027 presenta una maggiore area sotto la curva (AUC) e un’emivita più lunga con una clearance plasmatica ridotta rispetto ad un rFVIII ad azione standard.
Questo è uno studio in aperto che ha arruolato pazienti con emofilia A grave (FVIII: C <1%) di età compresa tra 12 e 65 anni senza inibitori precedentemente esposti a trattamento con FVIII di qualsiasi tipo per più di 150 giorni.
I pazienti sottoposti a intervento chirurgico sono stati trattati utilizzando dosi e frequenza di somministrazione di FVIII che si prevede vengano utilizzati, a secondo la tipologia delle procedure chirurgiche, nel rispetto delle raccomandazioni standard del Treatment Guidelines Working Group The World Federation Of Hemophilia. Comunque sia i protocolli terapeutici sono stati decisi dalle equipe dei singoli pazienti e i dosaggi sono stati programmati sui risultati dei laboratori afferenti agli ospedali in cui sono stati curati gli emofilici. Ovviamente tutti i soggetti arruolati sono stati trattati solo con BAY 94-9027 sino alla dismissione dall’ospedale.
L’outcome primario è stata la valutazione, al termine dell’intervento, dell’efficacia di BAY 94-9027 nel gestire il controllo del sanguinamento.
Al chirurgo è stato chiesto di confrontare in questi pazienti la perdita di sangue rispetto a quella prevista in pazienti senza emofilia sottoposti a procedure comparabili ed utilizzando una scala a 4 punti qui riportata:
- Eccellente: perdita di sangue inferiore al previsto
- Buono: perdita di sangue come previsto
- Moderato: perdita di sangue superiore al previsto
- Scarso: sanguinamento incontrollato.
I clinici hanno dovuto inoltre tener conto della necessità di eventuali trasfusioni durante il periodo perioperatorio, fino a 24 ore dopo l’intervento, dell’uso di antifibrinolitici, di eventuali tromboprofilassi e di complicanze secondarie ad eventuali sanguinamenti.
I pazienti sono stati trattati in 11 ospedali di 9 paesi differenti. Quattro pazienti hanno avuto 2 interventi chirurgici maggiori e un solo paziente ne ha avuti 3.
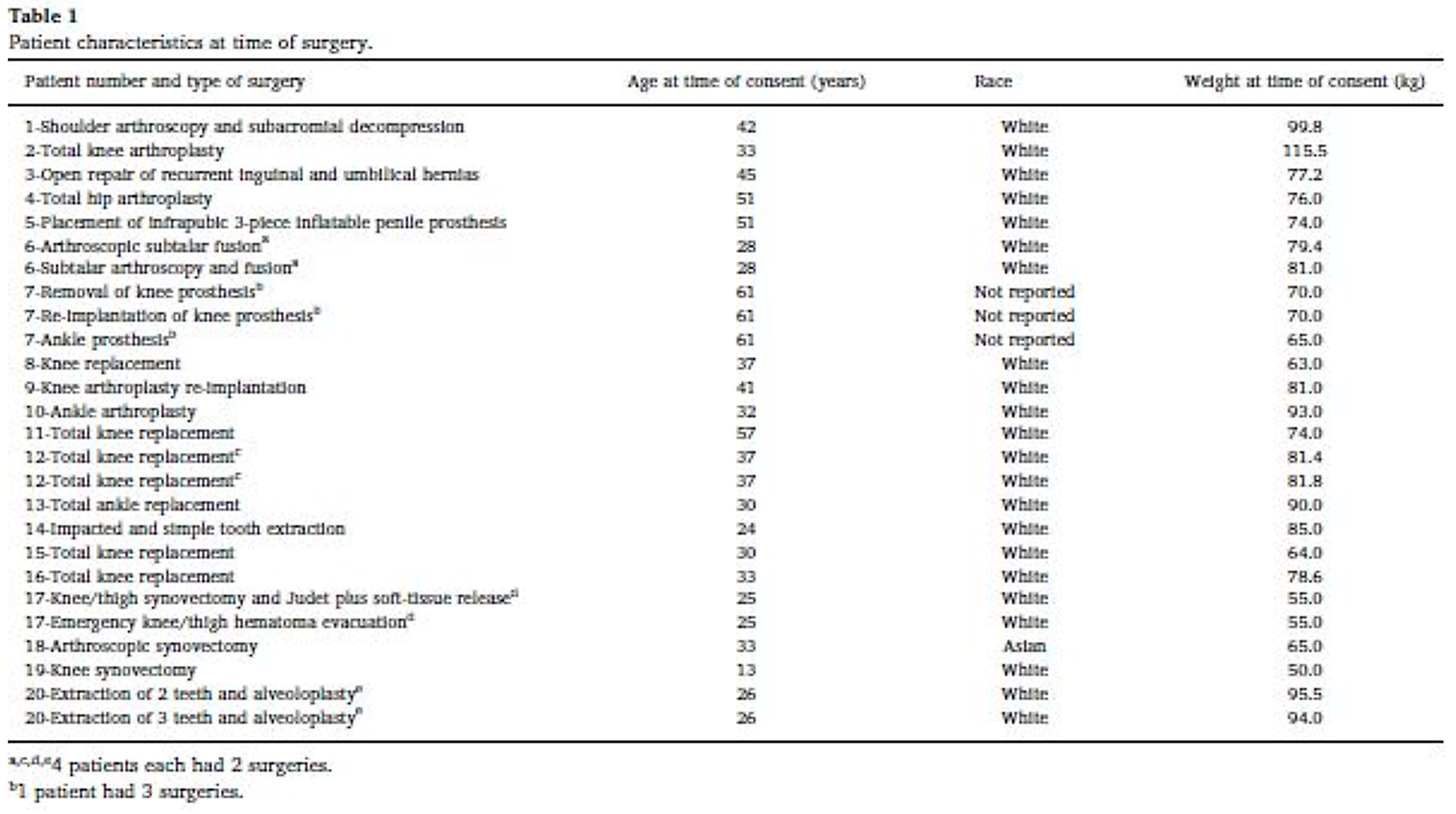
I 26 interventi chirurgici sono rappresentati da 21 interventi ortopedici (1 protesi d’anca,10 protesi di ginocchio e 3 protesi di caviglia, 2 aperte sinovectomia, 4 procedure artroscopiche e 1 ematoma ginocchio / coscia evacuazione), 3 estrazioni dentali complesse e 2 altre procedure (protesi peniena e riparazione dell’ernia inguinale). In totale, 20 pazienti di età compresa tra 13 e 61 anni per 26 interventi chirurgici. Dei 26 pazienti 10 erano partecipanti alla sperimentazione clinica PROTECT VIII. Dei venti pazienti, all’arruolamento, 5 (25%), 7 (35%) e 14 (70%) rispettivamente erano positivi per il virus dell’immunodeficienza umana (HIV), per il virus dell’epatite B (HBV) e per il virus dell’epatite C (HCV).
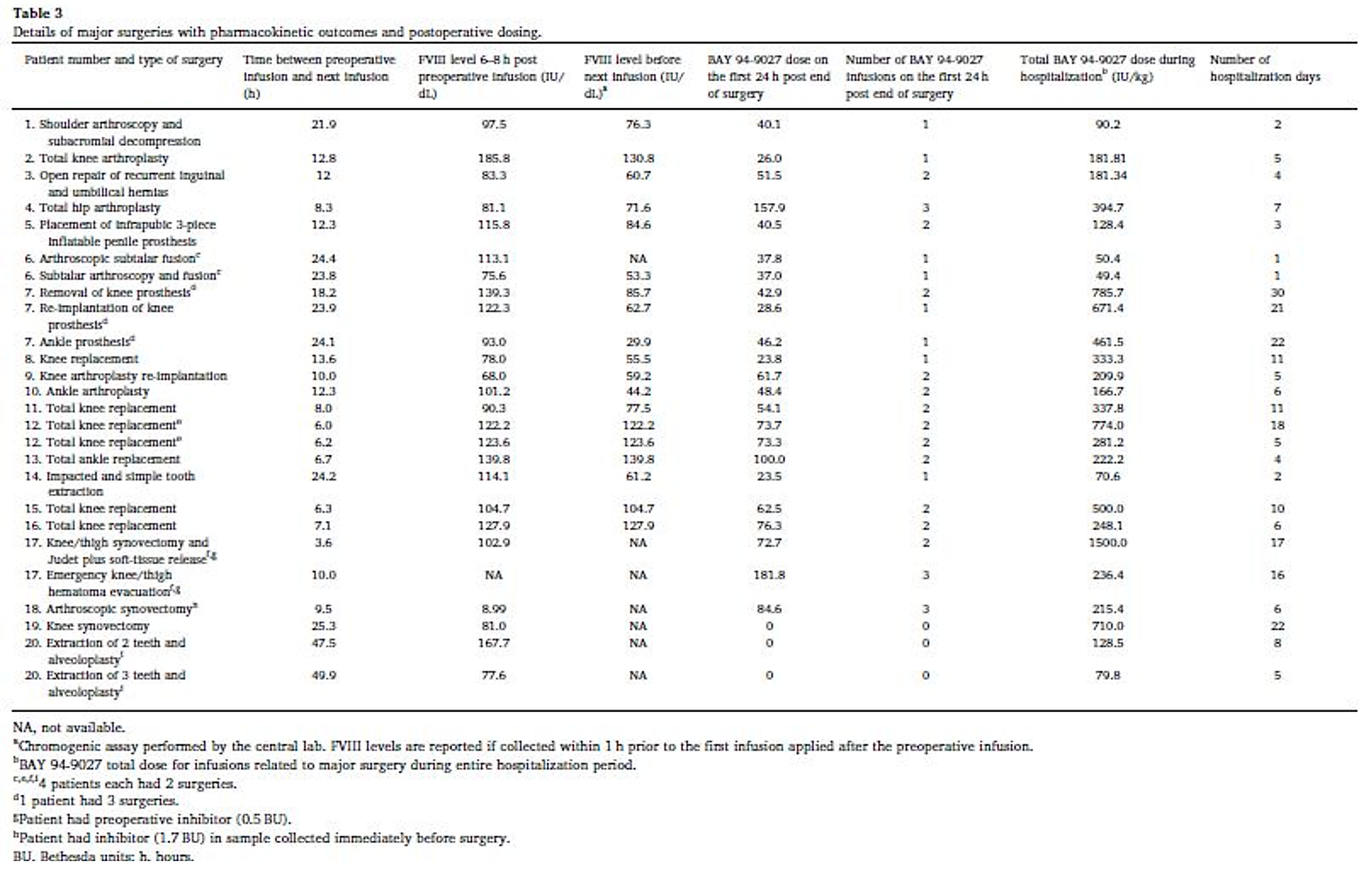
Nella table1 sono riportate le caratteristiche di base di tutti i pazienti inseriti nello studio. La table 2mostra invece il tipo di intervento chirurgico, la durata delle procedure e la valutazione della qualità dell’emostasi. La table 3 riporta i tempi tra il trattamento preoperatorio ed il primo del postoperatorio nonché il numero di trattamenti nelle prime 24 ore del postoperatorio.
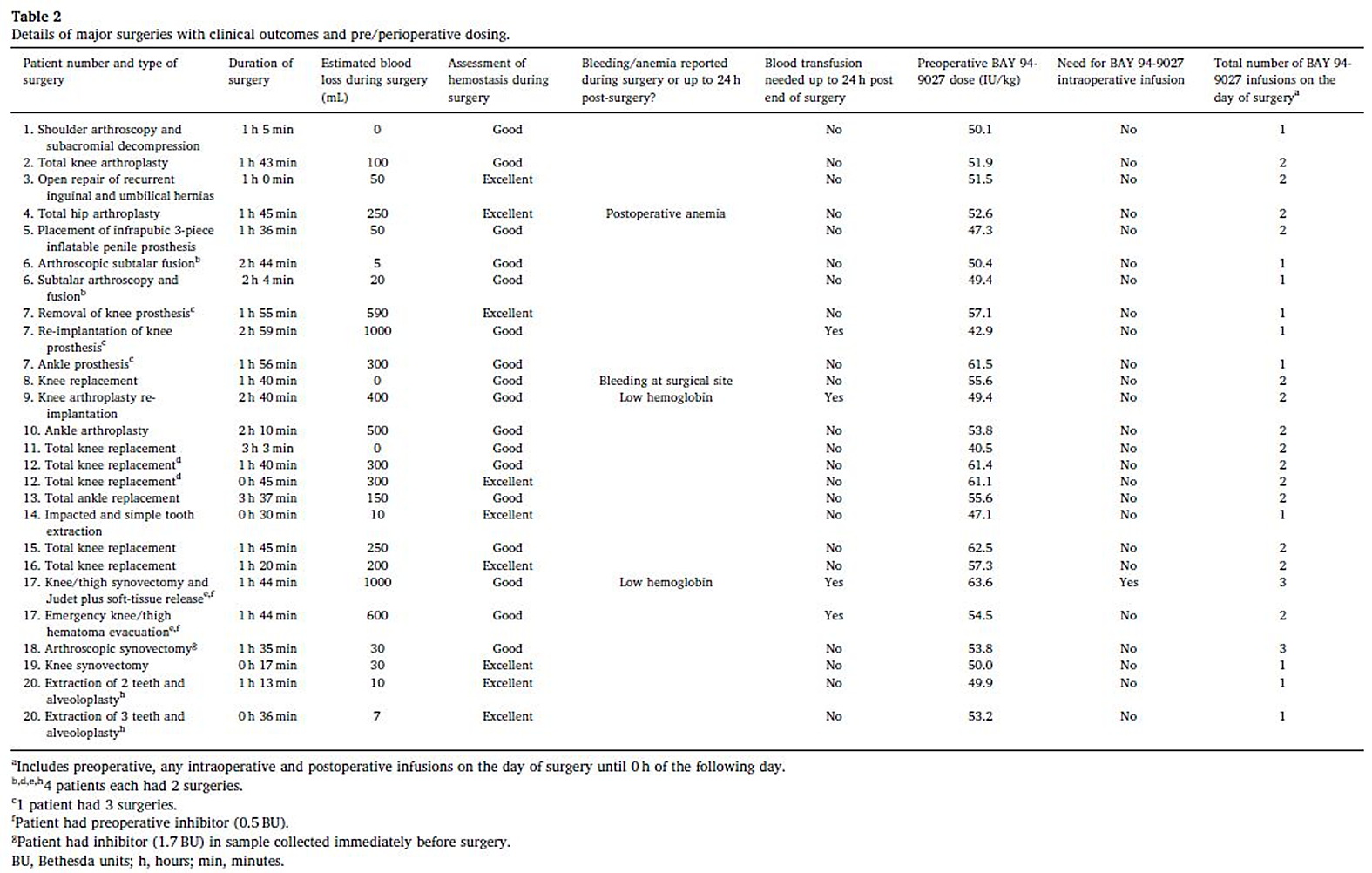
Come parte delle cure di routine, per prevenire il sanguinamento, sono stati utilizzati gli antifibrinolitici in 12 occasioni (11 ortopedici e 1 estrazione dentaria complessa). L’uso era indipendente dal rischio di sanguinamento ed eseguito secondo protocolli di trattamento dei singoli gruppi. Inoltre la profilassi antitrombotica è stata utilizzata nel perioperatorio solo dal paziente 11 con nadroparina.
L’emostasi nel corso degli interventi chirurgici è stata valutata come buona in 17casi/26 o eccellente in 9/26 e i clinici, in generale, hanno valutato che la perdita di sangue era simile o inferiore al previsto, rispetto a procedure simili in pazienti non emofilici.
La trasfusione di sangue intra o post operatoria è stata necessaria solo in 3 pazienti, 2 sostituzioni di ginocchio (pazienti 7 e 9) e 1 sinoviectomia del ginocchio (paziente 17). Interventi assolutamente compatibili con il tipo di chirurgia.
L’outcome primario di sicurezza è stato raggiunto poiché non sono stati segnalati eventi associati a complicanze emorragiche durante l’intervento chirurgico.
Non sono stati segnalati, dopo gli interventi, lo sviluppo di nuovi inibitori contro il FVIII (FVIII ≥0,6 BU mL-1). Non sono stati segnalati eventi trombotici vascolari. Nessun paziente ha sviluppato anticorpi anti-BAY 94-9027 o anti-PEG. Questi dati confermano l’ottima tollerabilità ed efficacia di BAY 94-9027 durante il periodo perioperatorio.
In questa coorte di pazienti studiati ritroviamo ad oggi il maggior numero di interventi di chirurgia maggiore eseguiti usando un FVIII a emivita estesa. Questi pazienti, rappresentando un gruppo eterogeneo trattati in 9 paesi diversi dall’Asia, all’Europa e al Nord America, riflettono quindi l’ampia variabilità che ritroviamo nella real life. Come tale, questa esperienza, sembrerebbe estensibile anche alla popolazione generale di pazienti con emofilia grave A.
A causa delle piccole dimensioni del campione e l’eterogeneità delle procedure e delle diverse modalità di raccolta delle informazioni sull’utilizzo di FVIII, è difficile fare confronti tra diversi prodotti di FVIII riguardanti il consumo e la frequenza di trattamento.
Si può comunque ricavare l’informazione che il consumo di BAY 94-9027 nel giorno dell’intervento chirurgico era simile o addirittura leggermente inferiore (intervallo 42,9-136,4 UI / kg) rispetto ai prodotti di FVIII standard, incluso turoctocog alfa (gamma, 27–153 UI / kg) e rFVIII a lunghezza intera non modificato (Kovaltry®; range, 59,5–207,3 UI / kg). Inoltre, i dati del consumo delle unità di BAY 94-9027 nel perioperatorio e il numero delle infusioni (range, 1–3 infusioni) nel giorno dell’intervento erano simili ad altri prodotti rFVIII a emivita estesa.
Un altro limite dello studio è l’eterogeneità delle indicazioni chirurgiche, che influenzando l’assistenza perioperatoria e la stessa durata della degenza ospedaliera possono determinare una variabilità nel consumo di BAY 94-9027 nel periodo postoperatorio. Infine anche l’eterogeneità degli standard delle procedure operative delle varie equipe può rappresentare un altro limite.
Comunque sia i 26 interventi di chirurgia maggiore presentati in questo studio hanno dimostrato che il BAY 94-9027 è in grado di fornire, in queste situazioni, un’ottima copertura emostatica, assicurando nel contempo un buon profilo di sicurezza. Un ulteriore vantaggio sembra la possibilità di utilizzare infusioni a più lunghi intervalli con un minor disagio dei pazienti e con una riduzione dei consumi.
Per approfondire
M.A. Escobar, A. Brewer, H. Caviglia, A. Forsyth, V. Jimenez-Yuste, L. Laudenbach, S. Lobet, P. McLaughlin, J.O.O. Oyesiku, E.C. Rodriguez-Merchan, A. Shapiro, L.P. Solimeno, Recommendations on multidisciplinary management of elective surgery in people with haemophilia, Haemophilia 24 (5) (2018) 693–702, https:// doi.org/10.1111/hae.13549.
C. Negrier, A. Shapiro, E. Berntorp, I. Pabinger, M. Tarantino, A. Retzios, P. Schroth, B. Ewenstein, Surgical evaluation of a recombinant factor VIII prepared using a plasma/albumin-free method: efficacy and safety of Advate in previously treated patients, Thromb Haemost 100 (2) (2008) 217–223.
E. Santagostino, S.R. Lentz, M. Misgav, B. Brand, P. Chowdary, A. Savic, Y. Kilinc, Y. Amit, A. Amendola, L.P. Solimeno, T. Saugstrup, I. Matytsina, Safety and efficacy of turoctocog alfa (NovoEight(R)) during surgery in patients with haemophilia A: results from the multinational guardian clinical trials, Haemophilia 21 (1) (2015) 34–40, https://doi.org/10.1111/hae.12518.
I. Scharrer, H.H. Brackmann, Y. Sultan, T. Abshire, C. Gazengel, M. Ragni, E. Gorina, E. Vosburgh, E. Kellermann, Efficacy of a sucrose-formulated recombinant factor VIII used for 22 surgical procedures in patients with severe haemophilia A, Haemophilia 6 (6) (2000) 614–618.
T.E. Coyle, M.T. Reding, J.C. Lin, L.A. Michaels, A. Shah, J. Powell, Phase I study of BAY 94-9027, a PEGylated B-domain-deleted recombinant factor VIII with an extended half-life, in subjects with hemophilia A, Journal of Thrombosis and Haemostasis 12 (4) (2014) 488–496, https://doi.org/10.1111/jth.12506.
M.T. Reding, H.J. Ng, L.H. Poulsen, M.E. Eyster, et al. Safety and efficacy of BAY 94-9027, a prolonged-half-life factor VIII, J Thromb Haemost 15 (3) (2017) 411–419, https://doi.org/10.1111/jth.13597.
J.N. Mahlangu, M. Ragni, N. Gupta, S. et al. Long-acting recombinant factor VIII Fc fusion protein (rFVIIIFc) for perioperative haemostatic management in severe haemophilia A, Thromb Haemost 116 (1) (2016) 1–8, https://doi.org/10.1160/TH15-10-0780.
K. Hampton, P. Chowdary, S. Dunkley, S. et al. First report on the safety and efficacy of an extended half-life glycoPEGylated recombinant FVIII for major surgery in severe haemophilia A, Haemophilia 23 (5) (2017) 689–696,