Dalcinonacog alfa è un fatttore IX di nuova generazione somministrabile per via sottocutanea candidato per il trattamento di soggetti con emofilia B.
Ad aprile del 2021 su haemophilia è stato pubblicato uno studio di fase 2b in aperto progettato per valutare come end-point primario l’efficacia e poi sicurezza, trombogenicità, immunogenicità e tollerabilità della profilassi sottocutanea con CB2679d (dalcinonacog alfa) in soggetti adulti emofilici B. Questo studio apre interessanti prospettive nella gestione della profilassi.
Dalcinonacog alfa è una nuova variante del rFIX sviluppata utilizzando un approccio progettuale con sostituzioni in tre punti (Arg318Tyr; Arg338Glu; Thr343Arg) che conferiscono una capacità catalitica più elevata di tre volte rispetto a quello del FIX wild-type per l’attivazione del fattore X e poi 10 volte più affine per il fattore VIII attivato (FVIIIa) e 15 volte più resistente all’inibizione da parte dell’antitrombina III.
Lo studio (NCT03995784) è stato condotto dal 18 giugno 2019 al 20 marzo 2020 in conformità con la Dichiarazione di Helsinki ed è stato approvato da un comitato etico indipendente e tutti i pazienti hanno fornito il consenso informato prima dell’arruolamento.
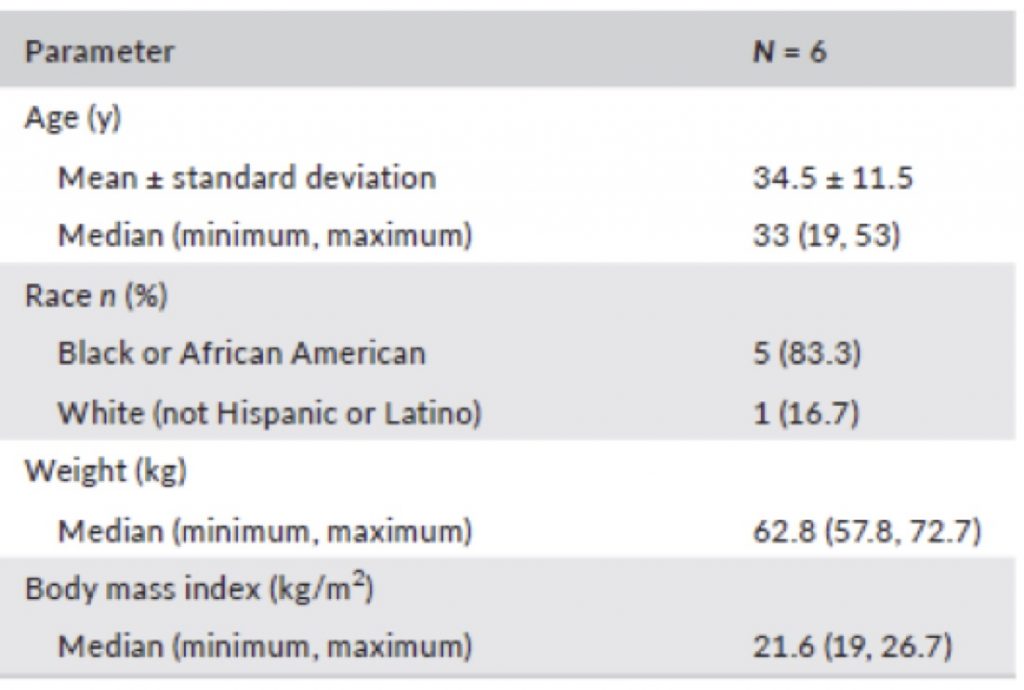
Questo studio ha incluso adulti con diagnosi confermata di emofilia B congenita con attività del fattore IX <2% (Tab.1)
Tab.1 Caratteristiche della popolazione studiata
Lo studio ha previsto la profilassi con Dalcinonacog alfa sottocute (SQ) condotta con una somministrazione giornaliera per 28 giorni con l’obiettivo di raggiungere livelli stabili di ≥12% di attività FIX.
Ogni partecipante arruolato nello studio ha ricevuto una dose I.V. di 50 UI/kg di dalcinnonacog per aumentare la saturazione del collagene IV seguiti 35 minuti dopo da dalcinonacog 100 UI/Kg, questa volta sottocute (SQ). A seguire sono state somministrate dosi SQ giornaliere di 100 UI/kg fino al ventottesimo giorno (28 dosi SQ totali). Infine l’emivita del fatt. IX è stato calcolato dopo l’ultimo trattamento previsto, ovvero tra il 29 / 33 giorno Fig.1.
Fig. 1 Schema dello studio

L’obiettivo primario è stato determinare il numero di partecipanti in grado di mantenere livelli stabili giornalieri di non meno del 12%.
Gli endpoint secondari hanno incluso la valutazione di eventuali e significativi livelli elevati di marker di trombogenicità derivanti dalla somministrazione di SQ di dalcinonacog alfa, una eventuale risposta anticorpale ad alto titolo (e se nel caso fosse neutralizzante-inibitorio e cross-reattivo al BeneFIX), variabili farmacocinetiche, immunogenicità e sicurezza.
Di undici pazienti scrinati 4 non sono stati elegibili e tra gli arruolati un soggetto in settima giornata ha interrotto lo studio per una reazione cutanea in sede di inoculazione. Gli altri cinque hanno completato regolarmente il trattamento previsto dallo studio.
I dati demografici dei soggetti arruolati sono riportati nella tab.1.L’età media è stata di 33 anni. Nel complesso, il numero medio di sanguinamenti registrati dai soggetti arruolati nei 6 mesi precedenti l’ingresso nello studio era di 1,5 (0-8), al termine dei primi 50 giorni dopo l’ingresso 0,5 (0–2). La compliance è stata del 99.4%.
Tab.2 parametri farmacocinetici
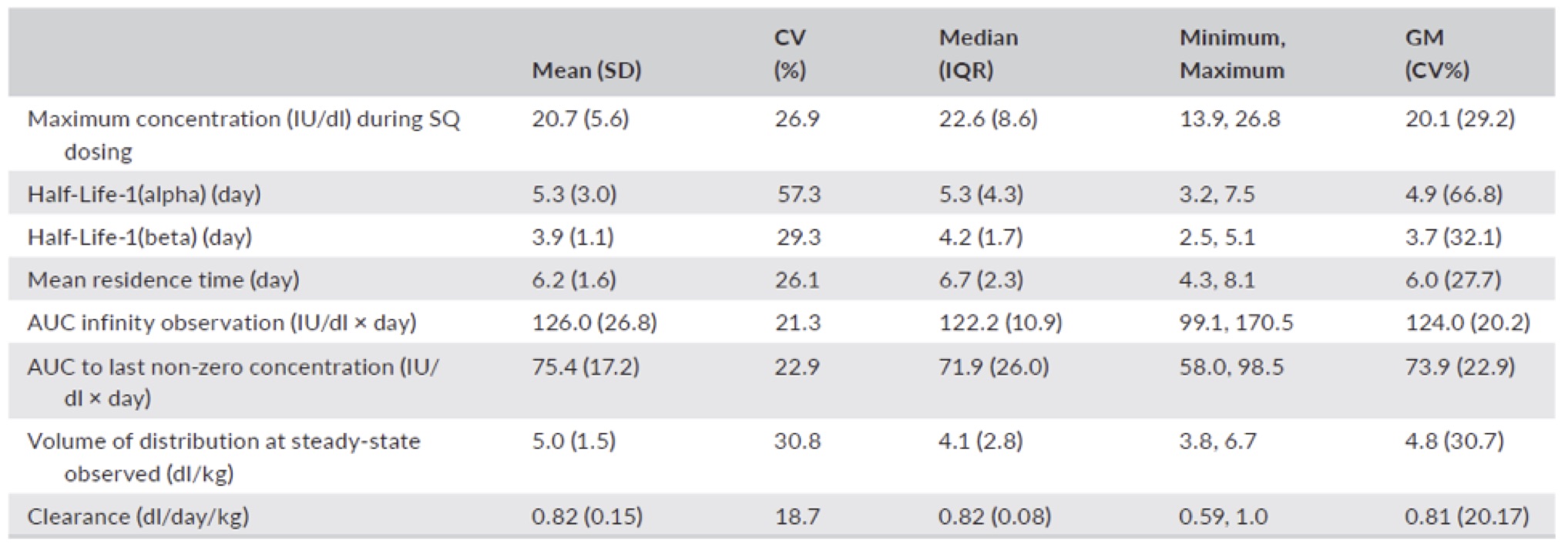
Abbreviazioni: AUC, area sotto la curva; CV, coefficiente di variazione; GM, media geometrica; IQR, range interquartile; SD, deviazione standard SQ,subcutanea.
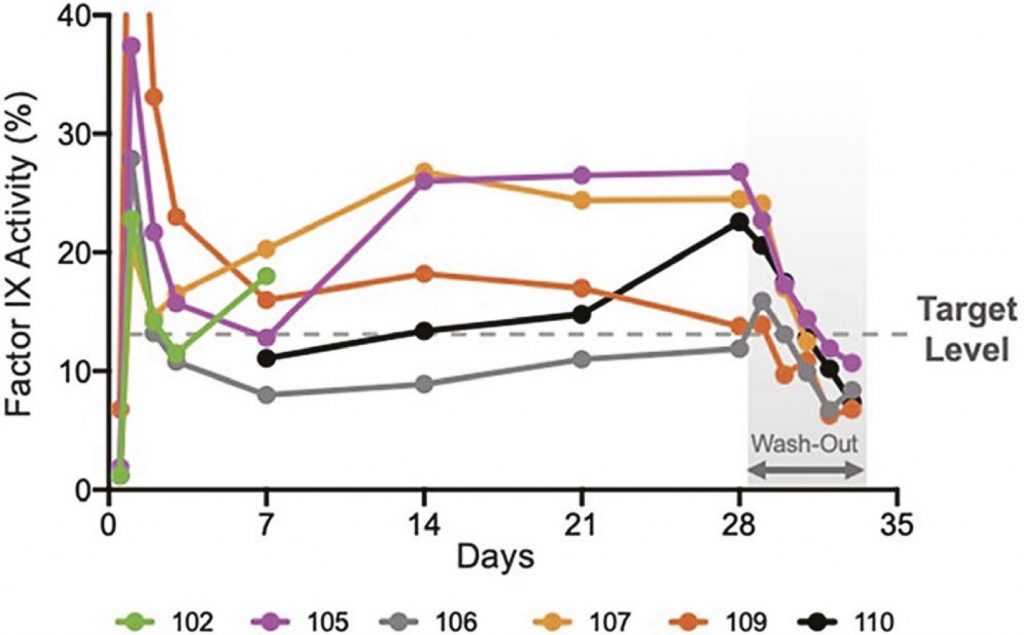
Tutti i pazienti hanno raggiunto e mantenuto durante lo studio un livello > 12% F.IX (Fig.2).Nessun evento emorragico durante lo studio. I dati farmacocinetici sono sintetizzati nella Tab.2. I ricercatori inoltre non hanno riscontrato anticorpi neutralizzanti anti-dalcinonacog (NAb) nei soggetti arruolati.
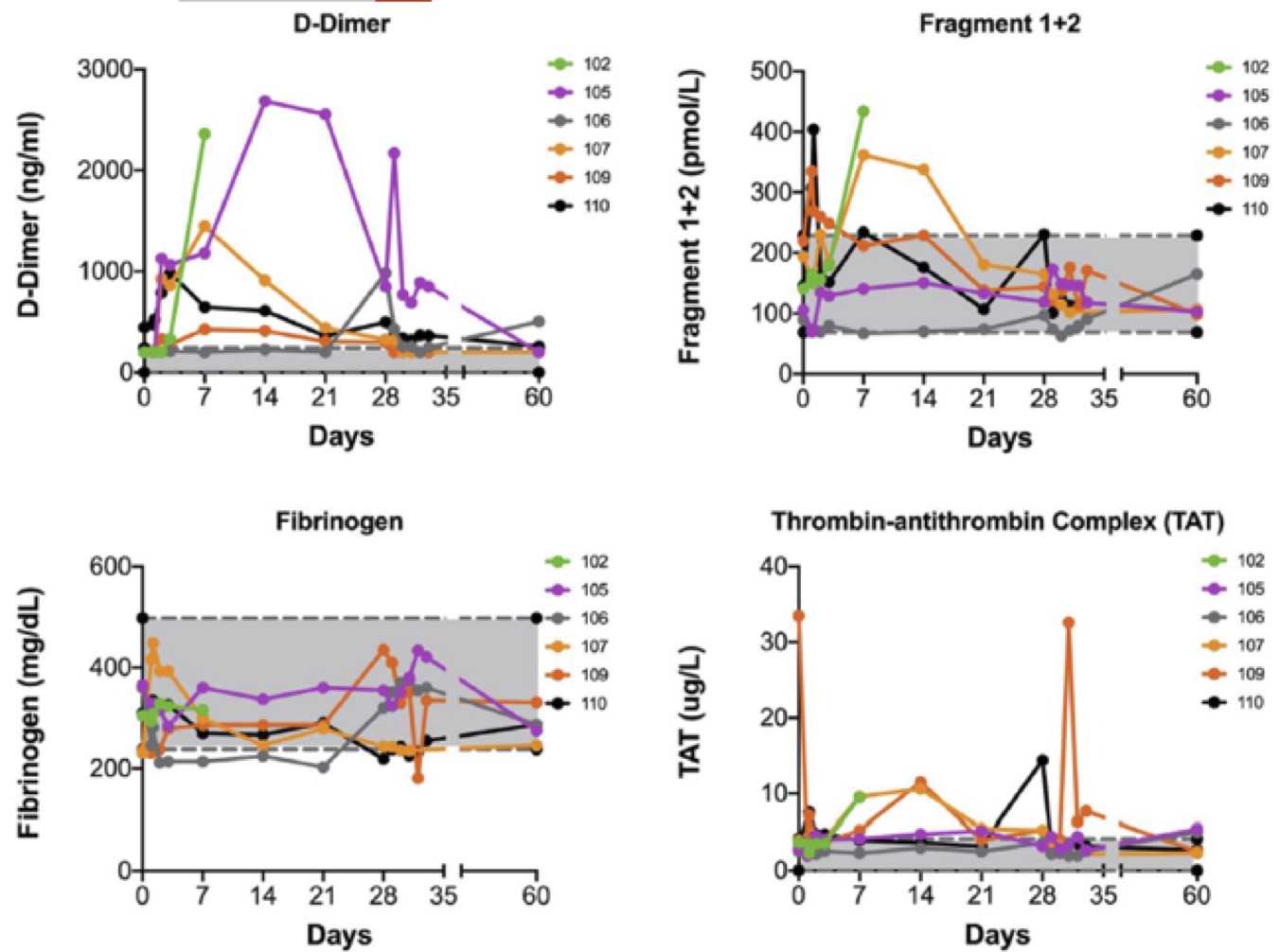
L’half-life alfa e beta sono stati rispettivamente di 5,3 e 3,9 giorni e mediamente il tempo di permanenza è stato di 6,2 giorni. Le variazioni dei marker di trombogenicità sono mostrati in Fig.3. e come riportano i grafici non si evidenziano modificazioni significative.
Fig. 3 marker di trombogenicità nel corso dello studio
In conclusione questo studio sembra dimostrare raggiunto l’obbiettivo primario per il quale è stato costruito ovvero la capacità di mantenere livelli stabili >12% di FIX e protettivi con la somministrazione SQ di dacinonacog alfa. Gli autori sottolineano tuttavia come sia importante sottolineare che le modifiche molecolari di proteine terapeutiche, come il F.IX, possono determinare epitopi non-self che potrebbero determinare una risposta immune. Tuttavia questo non sembra un problema importante come mostrato da Whelan et al. che hanno scoperto che circa il 30% dei pazienti con emofilia A hanno anticorpi che si legano al fattore VIII senza alcun effetto sull’esito del trattamento.
Fig.2 Livelli di attività del F.IX con dolcinanocog alfa SQ
Riferimenti
- Giangrande P. Haemophilia B: Christmas disease. Expert Opin Pharmacother. 2005;6(9):1517-1524.
- Mannucci PM. Hemophilia therapy: the future has begun. Haematologica. 2020;105(3):545-553.
- Stoner KL, Harder H, Fallowfield LJ, Jenkins VA. Intravenous versus subcutaneous drug administration. Which do patients prefer? A systematic review. Patient. 2015;8(2):145-153.
- Nichols TC, Levy H, Merricks EP, Raymer RA, Lee ML. Preclinical evaluation of a next-generation, subcutaneously administered, coagulation factor IX variant, dalcinonacog alfa. PLoS One. 2020;15(10):e0240896.
- Hong S-B,Levy H, Jung JY, et al. Pharmacokinetics of subcutaneously administered CB2679d/ISU304 in wild-typeand hemophilia B mice. Blood. 2016;128(22):1389.
- You CW, Hong SB, Kim S, et al. Safety, pharmacokinetics, and pharmacodynamics of a next-generationsubcutaneously administered coagulation factor IX variant, dalcinonacog alfa, in previously treated hemophilia B patients. J Thromb Haemost. 2021;19(4):967-975.
- Williams SC, Gray E. Activity measurements of dalcinonacog alfa. Haemophilia. 2020;26(2):346-353.
- Lee ML, Wai-Yin P, Kingdon HS. A two-phase linear regression model for biologic half-lifedata. J Lab Clin Med. 1990;115(6):745-748.
- Blouse GE. A Comprehensive in silico and in vitro immunogenicity risk assessment of dalcinonacog alfa shows no increased risk compared with wild-type FIX. Presented at the Second Annual 2019 Hemophilia Drug Development (HDD) Summit; August 21, 2019Boston, MA.
- Whelan SF, Hofbauer CJ, Horling FM, et al. Distinct characteristics of antibody responses against factor VIII in healthy individuals and in different cohorts of hemophilia A patients. Blood. 2013;121(6):1039-1048.



