Con uno scarno comunicato, qui affianco riprodotto, il 20 Aprile u.s. è stato confermato il primo caso di una comparsa di un anticorpo neutralizzante l’emicizumab in un paziente arruolato nello studio Haven 2, trial clinico di fase III volto a valutare l’efficacia e la sicurezza del farmaco in bambini emofilici A con inibitore di età inferiore a 12 anni. La comparsa dell’anticorpo anti-emicizumab si è tradotta in una perdita di efficacia del farmaco. Il trattamento con emicizumab è stato sospeso e il paziente è uscito dallo studio tornando alle terapie convenzionali.

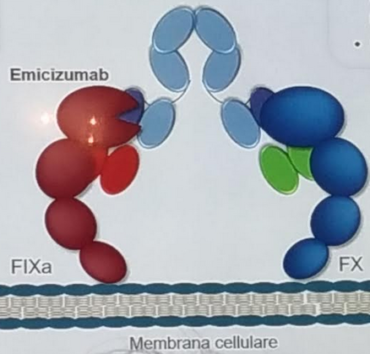
L’Emicizumab (ACE 910) non rappresenta una terapia sostitutiva ma è un anticorpo monoclonale ricombinante, umanizzato, bispecifico che lega il fattore attivato IX e il fattore X mimando così la funzione del fattore VIII che appunto manca nei soggetti con Emofilia.
Proprio per la sua struttura esso non è inattivato da un inibitore anti-VIII esistente e non è responsabile di una sua induzione. La sua somministrazione poi, e questo è un grande vantaggio, è sottocutanea.
I dati di efficacia riportati nell’Haven 1 e i risultati provvisori dell’Haven 2 sono stati di grande interesse e il 16 novembre 2017 la Food and Drug Administration degli Stati Uniti prima e poi il 23 febbraio u.s. l’EMA lo hanno approvato per l’uso nei pazienti con emofilia A e con inibitori.
L’utilizzo di una qualsiasi proteina con funzione terapeutica comporta un rischio potenziale per lo sviluppo di anticorpi specifici. Questa possibilità è stata oggetto di attenta sorveglianza all’interno dei programmi di sperimentazione clinica con emicizumab prima delle autorizzazioni dell’FDA e dell’EMA. Nessun paziente era risultato positivo per un anticorpo anti-farmaco all’interno dello studio HAVEN. Tuttavia le autorità regolatorie avevano prudentemente imposto ai produttori di descrivere nei bugiardini tale possibilità.
Ad oggi più di 600 persone con emofilia, con e senza inibitori del fattore VIII sono state trattate con emicizumab in tutto il mondo.
E questa è la prima conferma documentata di un anticorpo anti-emicizumab e sulla sua capacità di influenzare l’efficacia di emicizumab in un soggetto con emofilia A.
Lo sviluppo di un anticorpo anti-emicizumab va distinto dallo sviluppo di un inibitore del fattore VIII. In particolare, gli anticorpi diretti contro emicizumab possono influenzare la sua efficacia terapeutica ma non influenzano il quadro clinico dell’emofilia o lo sviluppo dell’inibitore anti VIII sottostante, né la capacità di gestire eventi emorragici con le terapie convenzionali come gli agenti bypassanti.
L’esclusivo meccanismo d’azione di emicizumab, per quanto dimostrato, ha implicazioni, per la sua peculiarietà d’azione, solo nella gestione degli eventi emorragici e un’influenza sui test di laboratorio.
La notizia è stata pubblicata anche dal sito della World Federation of Hemophilia (WFH) e dal Medical and Scientific Advisory Council (MASAC) della National Hemophilia Foundation (NHF), che ha redatto un aggiornamento sulle informazioni di sicurezza dell’ emicizumab e sulle raccomandazioni per la farmacovigilanza. La sicurezza dei pazienti, sottolinea il MASAC, è di primaria importanza ed è la ragione per cui esiste un sistema molto accurato di monitoraggio per l’emicizumab così come per tutti i farmaci, dai trial clinici alla sorveglianza post-marketing. Questa sorveglianza comprende anche la fase di utilizzo per uso compassionevole quando l’emicizumab possa rappresentare l’unica alternativa terapeutica. In quest’ultima condizione è possibile che pazienti molto compromessi vadano incontro a gravi eventi avversi o anche a morte. E’ necessario quindi un’accurata e completa registrazione dei dati di questi eventi, compresa la valutazione da parte del medico che sta seguendo il trattamento della possibile correlazione dell’evento con il farmaco in uso. Il MASAC ha anche fornito una guida a questo riguardo in una dichiarazione di orientamento provvisorio il 24 novembre 2017. Nell’ambito della recente revisione dei dati di sicurezza di emicizumab, condivisa da Genentech con la comunità dei pazienti il 26 Marzo 2018, sono stati segnalati 5 casi di morte in pazienti in trattamento con il farmaco, 3 dei quali per uso compassionevole. Nessuno dei decessi è stato considerato correlato al farmaco, per cui, pur non essendo noti ancora i dettagli relativi a questi 5 casi, il rapporto rischio-beneficio di emicizumab è stato considerato non modificato.
Dunque a seguito della prima segnalazione di un anticorpo anti-emicizumab il MASAC raccomanda, accanto ad una attenta sorveglianza sulla sicurezza, anche una continua vigilanza nella valutazione dell’efficacia clinica del nuovo farmaco. La perdita di efficacia può manifestarsi con un aumento degli episodi di sanguinamento spontanei e post traumatici. Un aiuto ad una corretta valutazione lo forniscono i comuni test di coagulazione. MASAC ha infatti pubblicato una guida in cui fornisce informazioni sui test che possono essere utilizzati per la valutazione dell’attività di emicizumab. I dosaggi cromogenici sono certamente i più sensibili. Tuttavia i test coagulometrici di attività del fattore VIII e dell’aPTT , i più disponibili nei laboratori, possono essere ugualmente utilizzati per valutare una perdita di efficacia. L’aPTT dovrebbe rientrare nell’intervallo di normalità in tutte le persone con emofilia e con inibitore del fattore VIII se ottenuto nel corso di un trattamento con emicizumab. Al contrario non esistono analisi disponibili per la determinazione di anticorpi specifici diretti contro emicizumab.
Queste informazioni e raccomandazioni sono di grande importanza alla luce del numero crescente, in Italia, di pazienti in trattamento con emicizumab sia se arruolati in programmi di sperimentazione clinica sia per la possibilità dell’uso compassionevole e, soprattutto, in vista della prossima disponibilità del farmaco sul mercato italiano.
RIFERIMENTI
Oldenburg J. Mahlangu JN, Kim B et al. Emicizumab Prophylaxis in Hemophilia A with Inhibitors. NEJM;2017 July 10:DOI: 10.1056/NEJMoa1703068
• https://news.wfh.org/first-case-anti-drug-antibody-reported-hemlibra-trial/
• http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/004406/human_med_002236.jsp&mid=WC0b01ac058001d124
• https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/761083s000lbl.pdf
• https://news.wfh.org/category/medical-news/
• www.hemophilia.org/Newsroom/Medical-News/MASAC-Safety-Information-Update-on-Emicizumab-HEMLIBRA
• Https://www.hemophilia.org/sites/default/files/MASAC-Update-on-the-Approval-and-Availability-of-the-New-Treatment.pdf
• https://endpts.com/roche-flags-first-case-of-anti-drug-antibodies-that-forced-a-patient-to-drop-would-be-blockbuster-hemlibra/
• https://www.hemlibra.com/
• https://www.gene.com/media/product-information/hemlibra
• http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/004406/human_med_002236.jsp&mid=WC0b01ac058001d124
• https://www.gene.com/contact-us/submit-medical-inquiry



