Testata l’efficacia anche nei soggetti di età inferiore a 12 anni.
Il deficit ereditario del fattore X (FX) è un raro disturbo emorragico autosomico recessivo con una prevalenza stimata di 1: 500 000 che a differenza dell’emofilia A e B interessa entrambi i sessi.
Il quadro clinico è sostanzialmente simile a quello osservabile nell’emofilia A e B: emartri, sanguinamenti muscolari e mucocutanei con un rischio non trascurabile di emorragia intracranica. Le donne colpite dal deficit presentono menorragia. Il sanguinamento può anche verificarsi spontaneamente, dopo un trauma minore o durante interventi chirurgici
In generale livelli di 10-20 UI / dL di attività del F.X (FX:C) sono considerati sufficienti per mantenere l’emostasi, ma alcuni individui possono manifestare sanguinamenti significativi nonostante abbiano livelli di FX: C superiori a 20 UI / dL.
Fino a poco tempo fa le opzioni per il trattamento delle emorragie nei soggetti con deficit di F.X erano limitate al plasma fresco congelato (FFP) e al concentrato del complesso protrombinico (PCC), che contiene, quest’ultimo, oltre al F.X anche i fattori II, VII e IX.
Tuttavia nessuno di questi trattamenti è specifico per il deficit congenito di FX; è quindi possibile che in corso di trattamento si possa osservare aumenti incoerenti e variabili nei livelli plasmatici sia del FX che degli altri fattori della coagulazione.
Inoltre il trattamento con FFP richiede dosi elevate che possono essere causa di sovraccarico di volume plasmatico e anafilassi. Mentre la PCC comporta un rischio di trombosi a causa dell’accumulo di altri fattori contenuti nel concentrato.
Nel 2016 l’EMA (Agenzia europea per i medicinali) ha autorizzato l’immissione in commercio del primo fattore X derivato da plasma umano (pd) (Coagadex® Bio Products Laboratory, Elstree, UK). Il primo e unico trattamento sviluppato specificamente per il trattamento a domanda o per la profilassi del deficit congenito di fattore X in adulti e bambini (di età sopra i 12 anni).
Austin SK et al. nel 2016, in uno studio pubblicato su Haemophilia, e condotto su 16 pazienti affetti da carenza ereditaria del fattore X, di età compresa tra 12 e 58 anni , ha dimostrato la sicurezza e l’efficacia di pd F.X (Coagadex) in profilassi e a domanda sia in ambito medico che chirurgico. Nel suo studio ha riportato 187 episodi e il trattamento è stato valutato “eccellente” o “buono” nel 98,4 % dei casi. L’esperienza nei bambini <12 anni, a quella data, era limitata a 3 soggetti che avevano ricevuto pdFX per uso compassionevole
Lo studio, che qui riportiamo in sintesi, è stato dunque progettato per verificare l’efficacia, la sicurezza del pd FX e studiarne la farmacocinetica nei trattamenti a domanda e nella profilassi dei bambini di età inferiore ai 12 anni con deficit di FX ereditario moderato o grave (Liesner R et al. Haemophilia 2018).
Lo studio, di tipo prospettico multicentrico non randomizzato ed aperto di fase 3 (ClinicalTrNCT01721681; EudraCT, 2012-003093-98), ha valutato la sicurezza, l’efficacia e la farmacocinetica del pdF.X in bambini al disotto di 12 anni in trattamento a domanda e in profilassi. Tutti i soggetti arruolati avevano un’attività plasmatica di base <5% U.I./dl.
L’endpoint primario è stato rappresentato dalla valutazione dell’efficacia nel ridurre o prevenire le emorragie dopo un periodo di osservazione di 26 settimane e comunque dopo 50 giorni di esposizione al pdF.X.
Gli endpoint secondari includevano il numero di sanguinamenti in un mese, la dose totale e il numero di infusioni, la dose media mensile e il numero di infusioni per soggetto.
Gli endpoint di sicurezza sono stati valutati a partire dalla prima dose di trattamento. I parametri di sicurezza valutati sono stati gli eventi avversi, lo sviluppo di eventuali inibitori e anomalie nelle valutazioni di laboratorio.
L’esperienza clinica è stata condotta in 9 soggetti di cui quatto di età inferiore a cinque anni e cinque tra i sei e gli undici. Di questi 8 avevano un deficit grave ed 1 moderato (Tab.1).
Tab.1 – Baseline demographic and clinical characteristics
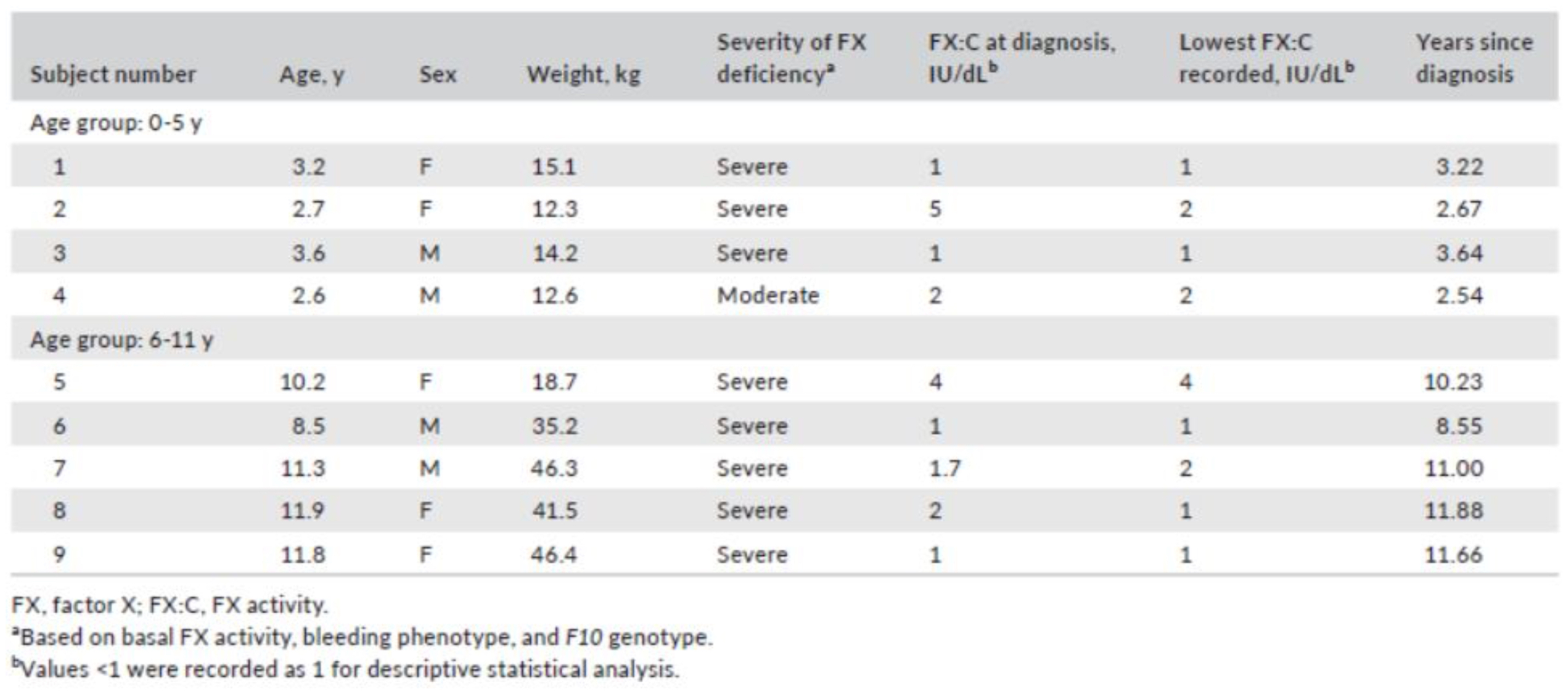
Tratto da R.Liesner L et al. Haemophilia. 2018;941–949.
Sono stati osservati e trattati dieci sanguinamenti (in 3 soggetti) 6 di gravità maggiore,
3 minore ed 1 non valutato (tab.2).
Tab.1 – Prophylactic use of pdFX for each subject
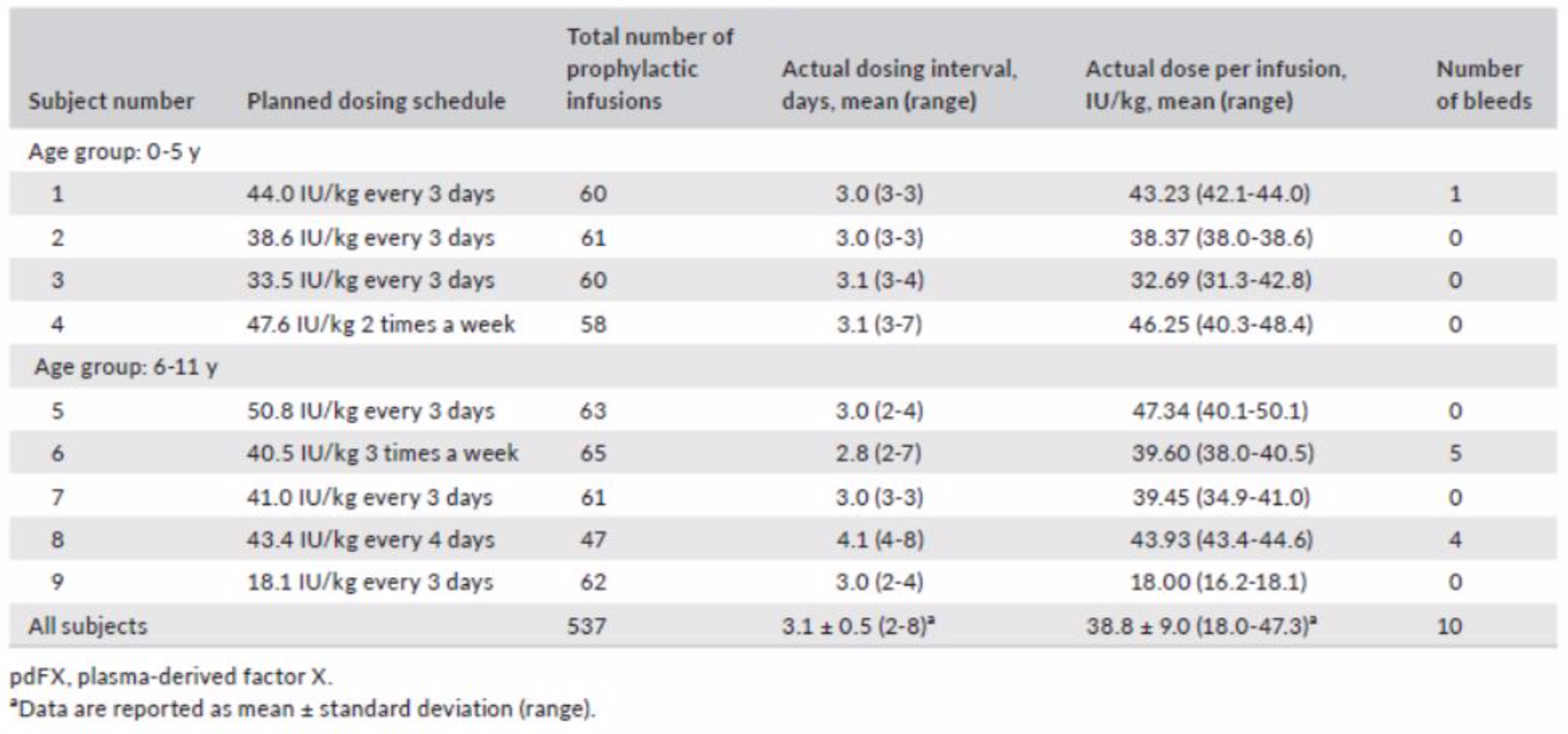
Tratto da R.Liesner L et al. Haemophilia. 2018;941–949.
Complessivamente nella popolazione arruolata sono state somministrate 537 infusioni in regime di profilassi. In media ciascun soggetto ha ricevuto un totale di 2302,4 ± 542,9 UI / kg di pdF.X, registrando un totale di 59,7 ± 5,1 infusioni. La dose media per ogni infusione è stata di 38,8 UI / kg e la somministrazione è avvenuta ogni 3,1 ± 0,5 giorni. La profilassi ha richiesto una dose media più alta per i soggetti giovani rispetto ai soggetti più anziani
Dopo 6 mesi di trattamento, i ricercatori hanno valutato l’efficacia di pdF.X come “eccellente”, nel prevenire o ridurre i sanguinamenti per ciascuno dei 9 soggetti arruolati, valutata sulla base della frequenza, della gravità dei sanguinamenti e sulla valutazione delle aspettative dei familiari dei pazienti e delle loro valuatzioni cliniche osservazionali.Questi i risultati sono sovrapponibili a quelli di uno studio precedentemente condotto in soggetti di età ≥12 anni in cui pdFX è stato utilizzato con successo nel 97% di soggetti in cui l’83% dei sanguinamenti sono stati trattati con una singola infusione.
Nelle analisi di farmacocinetica, sono stati sempre mantenuti livelli minimi di FX: C a> 5 UI / dL per tutti i soggetti dopo il periodo di aggiustamento della dose. I ricercatori sottolineano poi come la farmacocinetica del pdFX può differire per i bambini di età inferiore ai 5 anni rispetto ai bambini più grandi con variazioni non importanti ma significative statisticamente.
In conclusione questi risultati dimostrano l’efficacia e la sicurezza di pdFX per il trattamento anche nei bambini <12 anni con deficit congenito moderato e grave del F.X .
Riferimenti
- Austin SK, Brindley C, Kavakli K, Norton M, Shapiro A; Group FXI. Pharmacokinetics of a high-purity plasma-derived factor X concentrate in subjects with moderate or severe hereditary factor X deficiency. Haemophilia. 2016;22:426‐432.
- Austin SK, Kavakli K, Norton M, Peyvandi F, Shapiro A, Group FXI. Efficacy, safety and pharmacokinetics of a new high-purity factorX concentrate in subjects with hereditary factor X deficiency. Haemophilia. 2016;22:419‐425.
- R. LiesnerC. AkaneziM. NortonJ. Payne Prophylactic treatment of bleeding episodes in children <12 years with moderate to severe hereditary factor X deficiency (FXD): Efficacy and safety of a high‐purity plasma‐derived factor X (pdFX) concentrate. Haemophilia. 2018;941–949.. https://doi.org/10.1111/hae.13500
- https://www.ema.europa.eu/documents/…/coagadex-epar-medicine-overview_it.pdf
- https://www.ema.europa.eu/documents/…/coagadex-epar-product-information_it.pdf
- https://www.coagadex.com/
- https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=IT&Expert=455728



