Negli ultimi decenni la letteratura ha ampiamente dimostrato che, nei pazienti con emofilia A, la profilassi rappresenta lo standard di cura in grado di modificare il fenotipo emorragico nei pazienti.
Negli ultimi anni, per facilitare l’aderenza alla terapia e per assicurare livelli minimi più elevati di fattore VIII, la ricerca si è impegnata per lo sviluppo di fattori di sostituzione con caratteristiche capaci di presentare un’emivita più estesa (EHL) rispetto ai fattori di sostituzione standard.
Attualmente i metodi impiegati per prolungare l’emivita di FVIII ricombinante sono rappresentati dalle tecnologie che utilizznoa la peghilazione e il legame con il recettore Fc.
Nella terza edizione delle Linee guida della Federazione Mondiale dell’Emofilia per la Gestione dell’Emofilia, di recente pubblicate a cura di Srivasta et al., si ribadisce appunto la solidità terapeutica nell’utilizzo di questi nuovi prodotti, sottolineando nello stesso tempo come non vi siano differenze farmacocinetiche (PK) significative tra i prodotti EHL VIII.
Tuttavia, e qui si inserisce un intervento di Berntorp, Krassova e Aledort , comparso recentemente su Haemophilia (2021, 1-3), in cui gli autori riportano che sono emerse in letteratura segnalazioni che potrebbero mettere in dubbio quanto riportato appunto sulle linee guida di cui sopra; sebbene resti poi da dimostrare se questa differenze farmacocinetiche si traducano in significato clinico.
Gli autori citano infatti due studi di confronto, prospettici, recentemente pubblicati, dove si dimostrano differenze rilevanti e significative tra i parametri farmacocinetici chiave di diversi prodotti EHL FVIII.
Il primo del 2019, Shah et al., ha realizzato un confronto diretto dei profili PK di due prodotti EHL FVIII, il BAY 94-9027 (damoctocog alfa pegol; Jivi®, Bayer AG, Germania) e la proteina di fusione FVIII Fc ricombinante Elocta (rFVIIIFc; Elocta/Eloctate®; Biogen, Cambridge, MA, USA), in 18 pazienti con emofilia A grave. Questo studio, disegnato con una dose singola, randomizzato e crossover, ha presentato la caratteristica di valutare i parametri farmacocinetici utilizzando lo stesso dosaggio, normalizzato per peso corporeo, nella stessa popolazione di pazienti, consentendo così un confronto tra i due prodotti. In questa analisi, gli autori hanno osservano un aumento significativo dell’area media geometrica sotto la curva (P = 0.0001), riduzioni significative della clearance (P = 0.0001) e un’emivita media geometrica significativamente più lunga dopo infusione del BAY 94-9027 rispetto all’Elocta rFVIIIFc (P <.05, Tabella 1).
Utilizzando un modello “popPK” è stato possibile notare, dopo una singola infusione di BAY 94-9027, un tempo più lungo per diversi livelli di soglia di FVIII (1, 3, 5 e 10 UI/dl) rispetto a quanto è rilevabile con l’uso dei rFVIIIFc ( Shah et. 2019) . Ciò consentirebbe intervalli più lunghi tra le dosi o livelli di FVIII più elevati per periodi più lunghi.
Anche il secondo studio citato, Solms et al. (2020), molto simile al precedente, a dose singola, randomizzato, crossover, ha riportato differenze significative nell’area sotto la curva, nella clearance e nell’emivita tra due prodotti EHL FVIII (Tabella 1). I parametri PK di BAY 94-9027 e BAX 855 (rurioctocog alfa pegol; Adynovi®/Adynovate®; Takeda, Giappone) sono stati confrontati direttamente in 18 pazienti con emofilia A grave e la superiorità del PK di BAY 94-9027 è stata chiaramente osservata in ciascuno
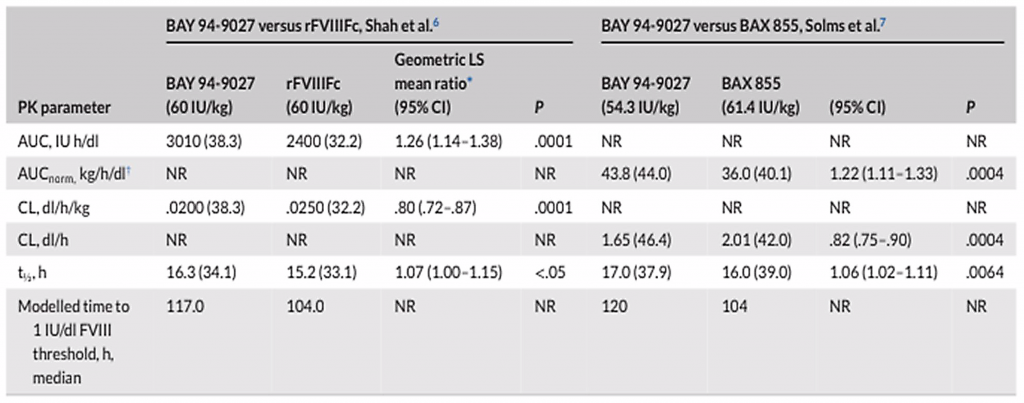
Tabella 1, dati nei parametri di PK dopo singole infusioni di prodotti EHL in sudi crossover (AUC- area sotto la curva, AUC norm – area sotto la curva normalizzata per dose per p.c., Cl –clearance)
dei parametri riportati. Questi dati dimostrerebbero chiaramente che esistono differenze, anche se non di grado elevato, nei parametri farmacocinetici tra i prodotti EHL FVIII. Rimane ovviamente da definire il significato clinico di queste differenze. Di contro, e a favore della posizione delle Linee Guida, gli autori riportano un lavoro di Carcao et 2019, in cui utilizzando Wapps-hemo.org (software per la valutazione del profilo farmacocinetico), andava a dimostrare come in adolescenti con emofilia non vi fossero differenze nel PK tra un rVIII-Fc (Elocta) e un rF.VIII peghilato (Bax855).Non venivano inoltre riscontrate differenze significative per l’emivita, l’area sotto la curva e la clearance.
Tuttavia Berntop et al. fa notare che questo studio non è stato concepito come un crossover e quindi non sono stati effettuati confronti incrociati tra i differenti prodotti. Gli studi testa a testa superano i problemi relativi alla variabilità tra pazienti, riducendo così al minimo il potenziale di confusione e garantendo un confronto valido e robusto tra prodotti.
Le differenze da 1,4 a 1,6 volte nell’emivita osservate tra i prodotti con emivita standard e EHL FVIII sono oggettivamente significative, anche se queste sono relativamente piccole se paragonate a quelle osservate per il fattore IX. Tuttavia, è importante notare che l’emivita non è la unica variabile da considerare quando si confronta l’efficacia tra due prodotti. Oltre all’emivita, altri parametri PK, come l’aumento dell’area sotto la curva e una clearance ridotta, potrebbero avere un significato clinico, traducendosi in una protezione dai sanguinamenti più a lungo e riducendo così il rischio di sanguinamento spontaneo nelle articolazioni.
Tuttavia gli autori sottolineano che questo aspetto non è ancora stato studiato con degli studi clinici e il suo reale significato ci rimane dunque sconosciuto.
Quindi ad oggi, in assenza di studi di efficacia e sicurezza testa a testa (crossover) tra i vari prodotti, gli studi sulla PK rimangono i più indicativi.
A conclusione della loro nota gli autori concludono che comunque, anche per la loro validità e affidabilità, i risultati dei due studi crossover presenti in letteratura suggeriscono che esistono certamente differenze nelle caratteristiche del PK dei i vari EHL. Ovviamente studi supplementari e indipendenti sono auspicabili per confermare questi dati.
Rimane comunque una domanda a cui ancora non è possibile dare una risposta e se cioè queste differenze significative nel Pk dei i prodotti EHL si traducano in un differente comportamento clinico.
Riferimenti
- Shah A, Solms A,Wiegmann S, et al. Direct comparison of two extendedhalf-life recombinantFVIII products: a randomized, crossover pharmacokinetic study in patients with severehemophilia A. Ann Hematol. 2019;98(9):2035-2044
- Solms A, Shah A, Berntorp E, Lissitchkov T. Direct comparison of two extended half-lifePEGylated recombinant FVIII products: a randomized, crossover pharmacokinetic study inpatients with severe hemophilia A. Ann Hematol. 2020;99(11):2689-2698.
- Carcao MD, Chelle P, Clarke E, et al. Comparative pharmacokinetics of two extended half- life FVIII concentrates (Eloctate and Adynovate) in adolescents with hemophilia A: is therea difference?. J Thromb Haemost. 2019;17(7):1085-1096
- Shah A, Solms A,Wiegmann S, et al. Direct comparison of two extendedhalf-life recombinantFVIII products: a randomized, crossover pharmacokinetic study in patients with severe hemophilia A. Ann Hematol. 2019;98(9):2035-2044.



