Efficace nel controllo dell’emostasi in chirurgia maggiore e minore nei pazienti con emofilia A grave di tutte le età
Recentemente (Haemophilia. 2020; 26:450–458.) sono stati pubblicati i risultati globali dello studio (panthfinder 3 e 5) di efficacia e sicurezza di fase III del Turoctocog alfa pegol: fattore VIII ricombinante glico-PEGilato con ad emivita estesa con indicazione alla profilassi, al trattamento delle emorragie e alla gestione peri-operatoria dei pazienti con emofilia A. Turoctocog alfa pegol richiede dosaggi meno frequenti e ha un’emivita fino a 1,6 volte in più rispetto ai prodotti FVIII standard.
Il Turoctocog alfa pegol ha già dimostrato, nelle pubblicazioni del 2017, la sua efficacia nella prevenzione e nel trattamento dei sanguinamenti peri-operatori negli interventi chirurgici maggiori.
Questo nuovo studio raccoglie una coorte più ampia di pazienti ed inoltre presenta per la prima volta i risultati di efficacia nei pazienti, sottoposti ad interventi chirurgici minori, di età inferiore ali 12 anni (pathfinder 3 e pathfinder 5).
In breve nel pathfinder 3 sono stati arruolati maschi di età ≥12 anni con emofilia A congenita grave (attività FVIII<1%) e con ≥150 giorni di esposizione (ED) ad un qualsiasi FVIII; nel pathfinder 5 sono invece raccolti soggetti di età <12 anni sempre con emofilia A grave congenita (FVIII attività <1%) e con almeno > 50 giorni di esposizione a qualsiasi FVIII se di età ≤5 anni e con > 150 giorni di esposizione se di età compresa tra 6 e 11 anni con un peso corporeo ≥10 kg 7.
Nel pathfinder 3, i 36 adulti / adolescenti sono stati arruolati prevedendo un totale di 53 interventi chirurgici maggiori . Il Pathfinder 5 invece ha coinvolto 23 bambini per interventi chirurgici minori .
Per il trattamento perioperatorio (interventi chirurgici maggiori) gli adulti / adolescenti di età ≥ 12 anni con emofilia A grave (FVIII <1%) hanno rispettato un programma che ha previsto turoctocog alfa pegol a dosaggi tali da raggiungere livelli di attività di FVIII> 80% (pathfinder 3).
Per i bambini (0-11 anni), invece, da sottoporre a piccoli interventi chirurgici, è stato previsto un trattamento che poteva andare da 20 a 75 UI/kg di turoctocog alfa pegol a secondo delle valutazione dello sperimentatore (pathfinder 5).
L’endpoint primario ovviamente è stato identificato nell’efficacia emostatica in corso di chirurgia; gli endpoint secondari sono stati la valutazione quantitativa delle perdite di sangue, l’effetto emostatico dopo intervento, il consumo del fattore VIII, l’eventualità di trasfusioni ed infine la sicurezza e gli effetti collaterali.
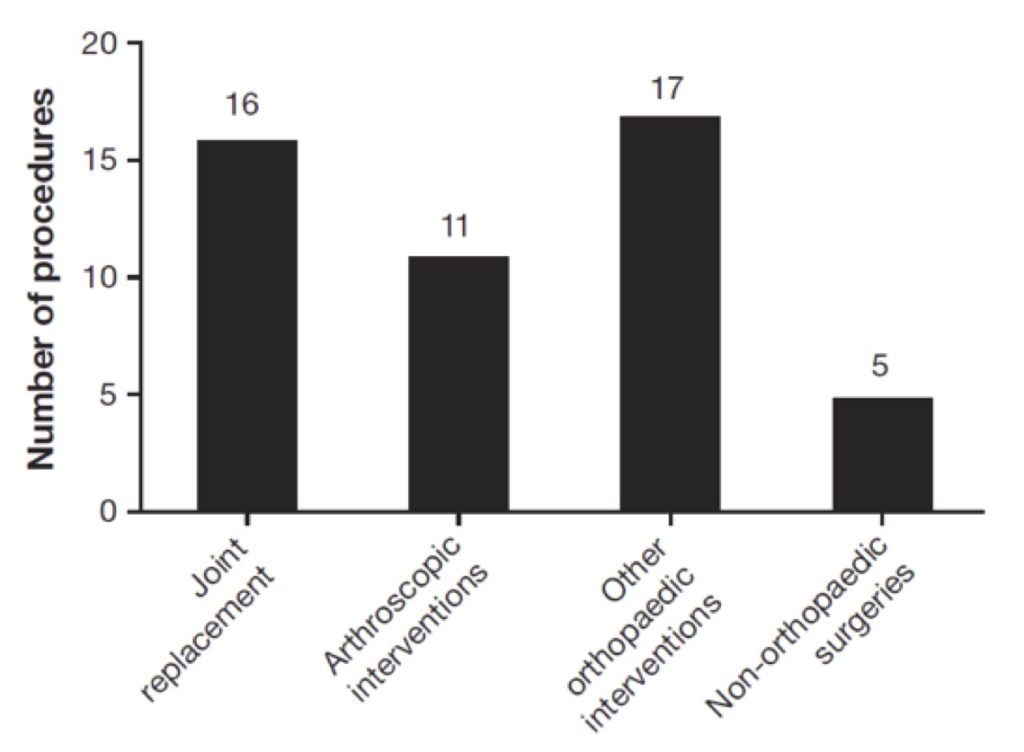
Quarantanove sono stati gli interventi di chirurgia maggiore nel pathfinder 3: 44 procedure ortopediche così suddivise, 16 protesi articolari, 11 interventi artroscopici e 17 altri interventi ortopedici; altri cinque pazienti sono stati sottoposti a interventi chirurgici non ortopedici (una mastectomia bilaterale, due colecistectomie, una circoncisione e una rimozione di uno pseudo-tumore (fig. 1).
Quarantacinque sono stati gli interventi chirurgici minori segnalati nel Pathfinder 5 eseguiti in 23 bambini: 29 estrazioni dentarie e altre procedure dentali minori, sette procedure relative a Port-a-Cath e altre nove procedure minori (fig. 1).
Fig.1
Tutti i principali interventi chirurgici negli adulti / adolescenti sono stati eseguiti in modalità assolutamente soddisfacente rispettando il protocollo stabilito.
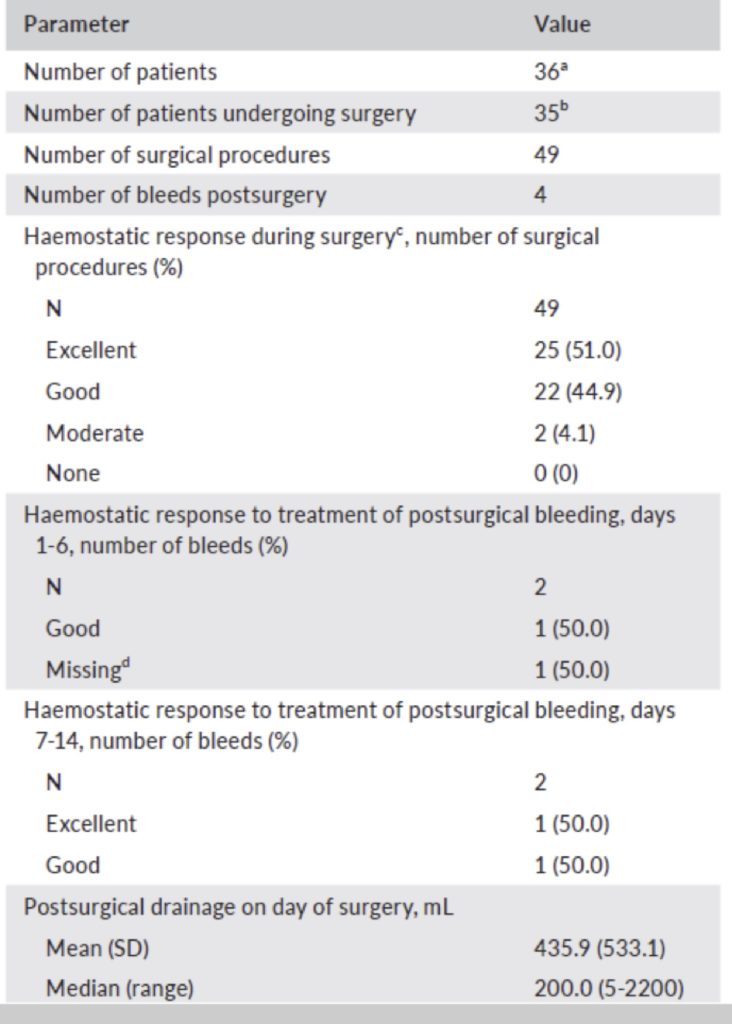
L’emostasi è stata valutata “eccellente” o “buona” nel 47/49 (95,9%) delle procedure relative agli adulti in chirurgia maggiore (Fig.2).
Fig.2
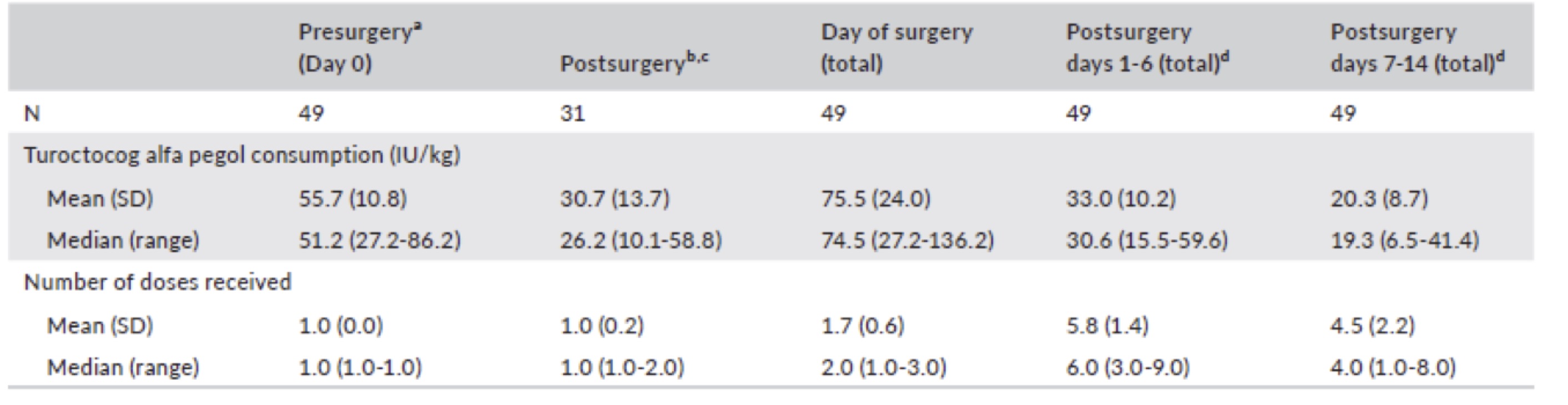
Nel giorno dell’intervento, la dose media complessiva è stata di 75,5 UI / kg, la mediana 74,5 UI / kg e il numero medio di dosi di 1,7, il numero mediano 2,0 (fig3).
Fig.3
Tutt i 45 interventi di chirugia minore nei bambini nel il pathfinder 5 sono stati eseguiti senza complicazioni con turoctocog alfa pegol con i dosaggi stabiliti per la profilassi.
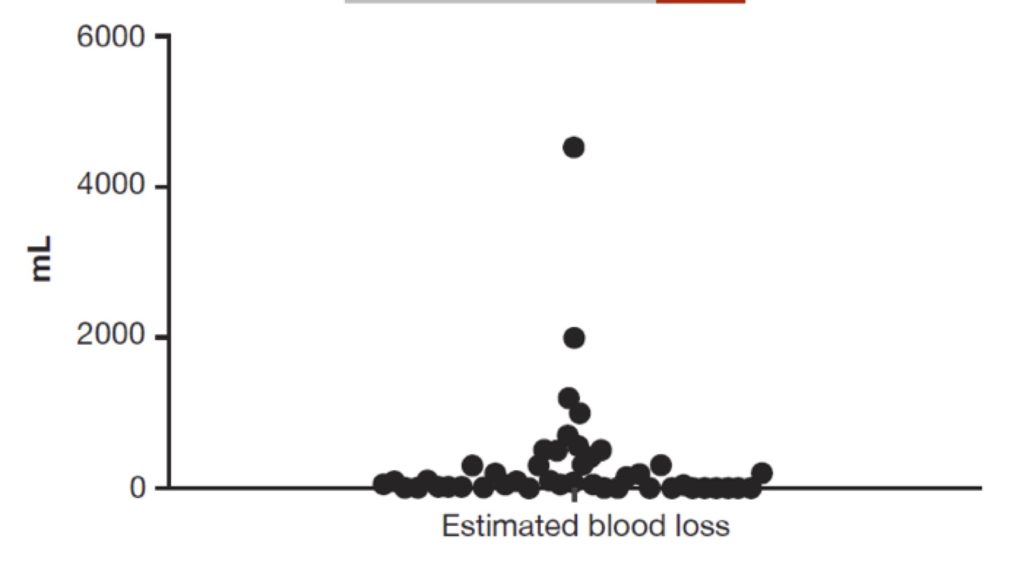
Nel pathfinder 3 la perdita di sangue mediana (media) durante la chirurgia maggiore è stata di 75 ml (322,6) con un intervallo: 0-4520 mL (fig.3).
Fig.3
Tra i 49 interventi del pathfinder 3 si sono riscontrati quattro sanguinamenti post-operatori; tre sono stati trattati con successo con turoctocog alfa pegol ed uno non valutato.
Cinque procedure hanno richiesto un totale di 11 trasfusioni nel giorno dell’intervento o in prima o sesta giornata.
Non sono state riportate osservazioni sulla sicurezza durante interventi chirurgici maggiori e nessuna segnalazione di evento tromboembolico sintomatico (o dati di laboratorio indicativi per rischio di eventi tromboembolici). Non si è documento sviluppo di inibitori.
I quarantacinque interventi chirurgici minori eseguiti in 23 bambini sono stati eseguiti senza complicazioni.
A parere degli autori, i risultati di questi studi forniscono ulteriori prove dell’efficacia emostatica e della sicurezza del turoctocog alfa pegol nella gestione perioperatoria e nel trattamento delle emorragie durante i principali interventi chirurgici negli adulti / adolescenti con emofilia A. Inoltre il turoctocog alfa pegol può essere utilizzato per gestire con successo e sicurezza le procedure chirurgiche minori nei bambini.
RIFERIMENTI
Ragni MV, Croteau SE, Morfini M, et al. Pharmacokinetics and the transition to extended half-life factor concentrates: communication from the SSC of the ISTH. J Thromb Haemost. 2018;16:1437-1441.
Hampton K, Chowdary P, Dunkley S, et al. First report on the safety and efficacy of an extended half-life glycoPEGylated recombinant FVIII for major surgery in severe haemophilia A. Haemophilia. 2017;23:689-696.
Giangrande P, Andreeva T, Chowdary P, et al. Clinical evaluation of glycoPEGylated recombinant FVIII: efficacy and safety in severe haemophilia A. Thromb Haemost. 2017;117:252-261.
Meunier S, Alamelu J, Ehrenforth S, et al. Safety and efficacy of a glycoPEGylated rFVIII (turoctocog alpha pegol, N8-GP) in paediatric patients with severe haemophilia A. Thromb Haemost.2017;117:1705-1713.
Tiede A, Brand B, Fischer R, et al. Enhancing the pharmacokinetic properties of recombinant factor VIII: first-in-human trial of glyco- PEGylated recombinant factor VIII in patients with hemophilia A. J Thromb Haemost. 2013;11:670-678.
U.S. Food and Drug Administration. Esperoct prescribing information. https://www.fda.gov/media /12035 1/download. Accessed June 17, 2019.
European Medicines Agency. Esperoct. https://www.ema.europa. eu/en/docum ents/overv iew/esper oct-epar-medic ine-overv iew_en.pdf. Accessed July 11, 2019.
European Medicines Agency Committee for Medicinal Products for Human Use (CHMP). Guideline on the clinical investigation of recombinant and human plasma-derived factor VIII products. EMA/CHMP/BPWP/144533/2009. http://www.ema.europa.eu/docs/en_GB/docum ent_libra ry/Scien tific_guide line/2011/08/WC500109692.pdf. Accessed February 3, 2016
Mullins ES, Stasyshyn O, Alvarez-Roman MT, et al. Extended halflife pegylated, full-length recombinant factor VIII for prophylaxis in children with severe haemophilia A. Haemophilia. 2017;23:238-246.
PDF A. Tosetto1 | A. Neff | S.R. Lentz | E. Santagostino et al. Turoctocog alfa pegol provides effective management formajor and minor surgical procedures in patients across all age groups with severe haemophilia A: Full data set from thepathfinder 3 and 5 phase III trials Haemophilia. 2020;26: 450–458.